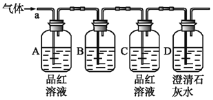
题目内容
【题目】下列关于实验操作的叙述不正确的是
A.蒸馏时,在烧瓶中加几粒沸石
B.加液时,胶头滴管悬置在试管正上方
C.萃取时,分液漏斗正立振荡后,直接放在铁架台上,静置
D.分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
【答案】C
【解析】
A、蒸馏时,为防止液体加热时剧烈沸腾在烧瓶中加几粒沸石防暴沸,A正确;
B、加液时,为防止液体受到污染,胶头滴管悬置在试管正上方,B正确;
C、萃取时,分液漏斗应倒转振荡后,再放在铁架台上,静置,C错误;
D、分液时,为防止液体二次污染,分液漏斗中的下层液体从下口放出,上层液体从上口倒出,D正确。
答案选C。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g) 2Z(g),ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是。
A. 反应前2 min的平均速率v(Z)=2.0×10-3mol·L-1·min-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.3 mol Z,平衡时X的体积分数增大
【题目】“废气”的综合处理与应用技术是科研人员的重要研究课题,CO、SO2、NO2是重要的大气污染气体。
(1)处理后的CO是制取新型能源二甲醚(CH3OCH3)的原料。
已知①CO(g)+H2O(g) CO2(g)+H2(g) ΔH1= -41.0 kJ/mol
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2= -49.0 kJ/mol
③CH3OCH3(g)+H2O(g) 2CH3OH(g) ΔH3= +23.5 kJ/mol
则反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的△H=________.
(2)已知973 K时,SO2与NO2反应生成SO3和NO,将混合气体经冷凝分离出的SO3可用于制备硫酸。
①973 K时,测得:NO2(g) NO(g)+ ![]() O2(g) K1=0.018;SO2(g) +
O2(g) K1=0.018;SO2(g) + ![]() O2(g) SO3(g) K2=20;则反应SO2(g)+NO2(g) SO3(g)+NO(g)的K3=________
O2(g) SO3(g) K2=20;则反应SO2(g)+NO2(g) SO3(g)+NO(g)的K3=________
②973K时,向容积为2 L的密闭容器中充入SO2、NO2 各0.2mol。平衡时SO2的转化率为______。
③恒压下,SO2的分压PSO2随温度的变化如图所示:
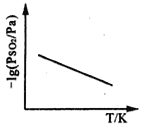
当温度升高时,SO2(g)+NO2(g) SO3(g)+NO(g)的化学平衡常数______(填“增大”或“减小”), 判断理由是______________________。
(3)用纳米铁可去除污水中的NO3-。
①纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O。研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是______________________。
②相同条件下,纳米铁粉去除不同水样中的NO3-的速率有较大差异。下表中Ⅰ和Ⅱ产生差异的原因可能是________________________________________;Ⅱ中0~20min,用NO3-表示的平均反应速率为______________mol·L-l·min-1。
反应时间/min | 0 | 10 | 20 | 30 | 40 | |
Ⅰ | c(NO3-)/10-4 mol·L-1 | 8 | 3.2 | 1.6 | 0.8 | 0.64 |
Ⅱ | c(NO3-)/10-4 mol·L-1 (含少量Cu2+) | 8 | 0.48 | 0.32 | 0.32 | 0.32 |
(4)用NaOH溶液吸收SO2可得NaHSO3溶液,对NaHSO3溶液中各离子浓度的关系,下列分析不合理的是___。(已知常温下K1(H2SO3)=1.5×10-2,,K2(H2SO3)=1.02×10-7)
A.c(Na+)+c(H+)=c(HSO3-) +2c(SO32-) +c(OH-)
B.c(Na+) =c(HSO3-) +c(SO32-) +c(H2SO3)
C.c(Na+) >c(SO32-) >c(HSO3-) > (OH-)c>c(H+)
D.c(H+) +c(SO32-) =c(OH-) +c(H2SO3)