题目内容
从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶,过滤、得到含结晶水的晶体;④将得到晶体在一定条件下加热得到无水氯化镁;⑤电解无水氯化镁,得到金属镁。下列说法中不正确的是
| A.此法的优点之一是原料来源丰富 |
| B.①②③步骤的目的是从海水中提取 MgCl2 |
| C.以上提取镁的过程中涉及化合、分解和复分解反应 |
| D.以上提取镁的过程中涉及的反应均不是氧化还原反应 |
D
解析试题分析:①把贝壳制成石灰乳反应为CaCO3 CaO+CO2↑,CaO+H2O=Ca(OH)2. ②Ca(OH)2+ MgCl2 =Mg(OH)2↓+CaCl2. ③Mg(OH)2+2HCl= MgCl2+H2O. ⑤MgCl2
CaO+CO2↑,CaO+H2O=Ca(OH)2. ②Ca(OH)2+ MgCl2 =Mg(OH)2↓+CaCl2. ③Mg(OH)2+2HCl= MgCl2+H2O. ⑤MgCl2 Mg+ Cl2↑.A.由以上化学反应可知制取的原料为贝壳、海水、盐酸。所以原料丰富。正确。B. ①②③步骤的目的是从海水中提取纯净的MgCl2。正确。C. CaCO3
Mg+ Cl2↑.A.由以上化学反应可知制取的原料为贝壳、海水、盐酸。所以原料丰富。正确。B. ①②③步骤的目的是从海水中提取纯净的MgCl2。正确。C. CaCO3 CaO+CO2↑,是分解反应,CaO+H2O=Ca(OH)2是化合反应. Ca(OH)2+MgCl2= Mg(OH)2↓+CaCl2、Mg(OH)2+2HCl= MgCl2+H2O.是复分解反应,MgCl2
CaO+CO2↑,是分解反应,CaO+H2O=Ca(OH)2是化合反应. Ca(OH)2+MgCl2= Mg(OH)2↓+CaCl2、Mg(OH)2+2HCl= MgCl2+H2O.是复分解反应,MgCl2 Mg+ Cl2↑是分解反应。故反应类型正确。D MgCl2
Mg+ Cl2↑是分解反应。故反应类型正确。D MgCl2 Mg+ Cl2↑既是分解反应,也是氧化还原反应。所以该选项错误。
Mg+ Cl2↑既是分解反应,也是氧化还原反应。所以该选项错误。
考点:考查制取金属镁的反应原理及海水的综合利用的知识。

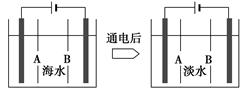
仅通过物理方法就能从海水中获得的物质是( )
| A.钠、镁 | B.溴、碘 | C.食盐、淡水 | D.氯气、烧碱 |
地壳中含量居第二位的非金属元素是
| A.铁 | B.铝 | C.氧 | D.硅 |
下列是部分矿物资源的利用及产品流程(如图),有关说法不平确的是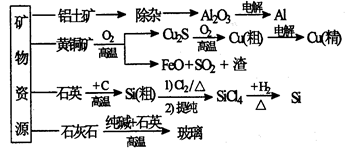
| A.粗铜电解精炼时,粗铜作阳极 |
| B.生产铝、铜、高纯硅及玻璃过程中都涉及氧化还原反应 |
| C.黄铜矿冶铜时,副产物SO2可用于生产硫酸,FeO可用作冶铁的原料 |
| D.粗硅制高纯硅时,提纯四氯化硅可用多次分馏的方法 |
水资源非常重要,虽然地球70%的面积被海水所包围,但淡水的比例只有2.5%,且其中绝大部分以冰川和其他形式存在,实际能够用来饮用的水不足全球淡水总量的1%。下列关于水的说法错误的是( )。
| A.蒸馏法是海水淡化的方法之一 |
| B.淡水的密度小于海水的密度 |
| C.融化的雪水中矿物质含量比深井水中的少 |
| D.0 ℃以上,温度越高,水的密度越小 |
金属锂是密度最小的金属,等质量的不同金属,锂可以释放出更多的电子,故常用来制造高性能电池。已知锂的金属性介于钠和镁之间,则冶炼金属锂应采用的方法是( )
| A.电解法 | B.热还原法 |
| C.热分解法 | D.铝热法 |
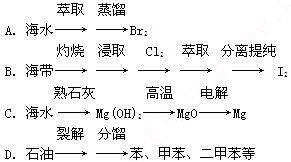
NaCl是海水中含量最多的盐,除食用外,它还是海洋化学工业原料,下列以NaCl为原料的产品(或物质)是( )
①烧碱 ②纯碱 ③金属钠 ④氯气 ⑤盐酸
| A.全部 | B.只有①②③④ |
| C.只有①②③⑤ | D.只有①②④⑤ |