题目内容
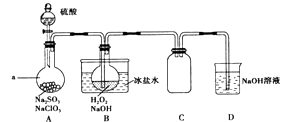
【题目】实验室可用NaClO3制取ClO2气体,再由ClO2制得NaClO2 , 实验装置如图所示:回答下列问题: 
(1)仪器a的名称为;装置C的作用是 .
(2)该实验必须使NaClO3稍微过量,目的是 .
(3)为使ClO2气体能被均匀、充分吸收,操作时应注意 .
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2﹣ , 则另一种为 .
(5)B中反应的离子方程式为 .
(6)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2 , 加入(填序号,下同)酸化,再加入检验. ①稀HNO3②稀H2SO4③K2SO3溶液 ④BaCl2溶液 ⑤FeCl2溶液 ⑥KSCN溶液
(7)预计NaClO3转化为NaClO2的转化率为80%,若要制得28.9g NaClO23H2O(相对质量:144.5),至少需g NaClO3(相对质量:106.5).
【答案】
(1)分液漏斗;防止倒吸
(2)使Na2SO3完全反应,避免产生SO2
(3)控制硫酸滴入速度
(4)ClO3﹣
(5)2ClO2+2OH﹣+H2O2=2ClO2﹣+2H2O+O2↑
(6)②;⑤⑥
(7)26.6
【解析】解:实验过程分析:装置A中盛放硫酸、NaClO3和Na2SO3 , 反应生成ClO2气体:2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O,ClO2气体和H2O2在B发生发生氧化还原反应:2ClO2+2OH﹣+H2O2=2ClO2﹣+2H2O+O2 , 发生反应可能使装置内压强降低,可能发生倒吸,装置C为防倒吸装置,装置D为尾气吸收装置;(1)根据图示可知仪器a为分液漏斗;亚硫酸钠具有还原性,在反应中作还原剂;装置A中产生ClO2的反应是氯酸钠在酸性溶液中氧化亚硫酸钠为硫酸钠,本身被还原为二氧化氯,ClO2进入装置B,发生反应使装置内压强降低,可能发生倒吸,装置C的作用为防止倒吸;所以答案是:分液漏斗;防止倒吸;(2)根据反应方程式可知使一种反应物过量,则另一种反应物反应完全,所以该实验必须使NaClO3稍微过量,目的是使Na2SO3完全反应,避免产生SO2 , 所以答案是:使Na2SO3完全反应,避免产生SO2;(3)缓慢通入ClO2 , 可以使ClO2气体被均匀、充分吸收,ClO2是硫酸、NaClO3与亚硫酸钠反应生成的,所以要使ClO2气体能被均匀、充分吸收,应该控制控制硫酸滴入速度;所以答案是:控制硫酸滴入速度;(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2﹣ , 氧化还原反应规律,另一种离子中Cl元素化合价升高,即为ClO3﹣;所以答案是:ClO3﹣;(5)B中发生反应为二氧化氯在碱性溶液中和过氧化氢发生氧化还原反应制得NaClO2 , 二氧化氯中Cl为+4价,变为NaClO2中的+3价,化合价变低,过氧化氢中的元素化合价应该升高,则H2O2中O元素化合价由﹣2价变为0价,产物为O2和H2O,反应的离子方程式为:2ClO2+2OH﹣+H2O2=2ClO2﹣+2H2O+O2↑,所以答案是:2ClO2+2OH﹣+H2O2=2ClO2﹣+2H2O+O2↑;(6)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2 , 加入非氧化性酸酸化,再加入含Fe2+的化合物,若有Fe3+生成,则证明NaClO2具有氧化性,用KSCN溶液检验Fe3+ , 现象是溶液变红;所以答案是:②;⑤⑥;(6)NaClO2具有氧化性,能将亚铁离子氧化为铁离子,用硫氰化钾检验铁离子即可,但是硝酸具有氧化性,会将亚铁离子氧化,所以用硫酸酸化但是不用硝酸酸化,所以答案是:②;⑤⑥;(7)28.9 g NaClO23H2O(式量:144.5),n(NaClO23H2O)= ![]() =
= ![]() =0.2mol,根据氯原子守恒知:n(NaClO3)=n(NaClO23H2O)=0.2mol,m(NaClO3)=n(NaClO3)M(NaClO3)=0.2mol×106.5g/mol=21.3g;NaClO3转化为NaClO2的转化率为80%,需所要NaClO3的质量为:
=0.2mol,根据氯原子守恒知:n(NaClO3)=n(NaClO23H2O)=0.2mol,m(NaClO3)=n(NaClO3)M(NaClO3)=0.2mol×106.5g/mol=21.3g;NaClO3转化为NaClO2的转化率为80%,需所要NaClO3的质量为: ![]() ≈26.6g,所以答案是:26.6.
≈26.6g,所以答案是:26.6.

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】表格中的各种情况,可以用如图的曲线表示的是( )
反 应 | 纵坐标 | 甲 | 乙 | |
A | 相同质量的氨,在同一容器中 | 氨气的转化率 | 500℃ | 400℃ |
B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
C | 向温度和压强都相同的甲乙两容器中分别投入体积比1:3的N2、H2(N2+3H2═2NH3) | 氨气的物质的量 | 反应过程中保持恒温恒容 | 反 应过程中保持恒温恒压 |
D | 2molSO2和1molO2 , 在相同温度下 | SO3 的浓度 | 2个大气压 | 10个大气压 |
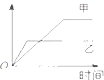
A.A
B.B
C.C
D.D