题目内容
【题目】A、B、C、D、E五种元素中只有E为金属元素,五种元素的原子序数按B、D、C、A、E的顺序依次增大,D、C元素在周期表中位置相邻,在一定条件下,B的单质可以分别和A、C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合可得丁,戊、己、庚均为化合物。已知乙、丙每个分子中均含有10个电子,下图为相互转化关系:
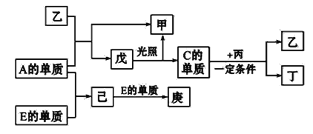
请回答下列问题:
(1)A在元素周期表中的位置:__________ ,写出实验室制取A的单质的离子反应方程式____________。
(2)戊的分子式为________。B与D形成的原子个数比为2∶1的化合物中,D原子最外层为8电子结构,请写出该化合物的电子式________________。
(3)C的单质与丙反应的化学方程式为______________________________。
(4)F为短周期元素,与C同主族,向己的溶液中通入FC2气体,发生反应的离子反应方程式为:_________________________________________ 。
(5)氟元素的非金属性比D元素强,用原子结构的知识解释__________________________。
【答案】第三周期第ⅦA族MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2OHClO
Mn2++Cl2↑+2H2OHClO![]() 4NH3+5O2
4NH3+5O2 ![]() 4NO+6H2O2Fe3++SO2+2H2O=2Fe2++SO42-+4H+F原子与N原子核外电子层数相同,但F元素的核电荷数比N元素的大,F的原子半径比N原子的小,F元素得电子能力比N元素强,所以氟元素的非金属性比N元素的强。
4NO+6H2O2Fe3++SO2+2H2O=2Fe2++SO42-+4H+F原子与N原子核外电子层数相同,但F元素的核电荷数比N元素的大,F的原子半径比N原子的小,F元素得电子能力比N元素强,所以氟元素的非金属性比N元素的强。
【解析】
这五种元素没有限定为短周期元素,由此可判断应该含有过渡元素,结合转化关系可知,E具有可变价态,即原子序数最大的金属元素E可能是Fe元素;B的原子序数最小,且与A、C、D反应分别生成甲、乙、丙化合物,其中乙、丙为10电子分子,可能是NH3和H2O,又C、D两元素相邻,所以B为H元素,C可能为O元素,D可能为N元素;A的单质与水反应生成一种光照可分解的物质(可能是HClO),可判断A可能为Cl元素,再结合转化关系进行全面推导,确定以上都是正确的。
(1)A是原子序数为17的Cl元素,在周期表的位置是第三周期第ⅦA族;实验室制取Cl2的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)氯气与水(乙)反应生成HCl(甲)和HClO (戊),所以戊的分子式为HClO;H和N形成的原子个数比为2∶1的化合物即N2H4,其电子式为![]() ;
;
(3)O2与NH3反应的化学方程式为4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
(4)F是与C同主族的短周期元素,即S元素,Cl2与铁化合生成己为FeCl3,将SO2通入FeCl3溶液中,发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(5)F与N两元素的原子核外电子层数相同,但F元素的核电荷数比N元素的大,F的原子半径比N原子的小,F元素得电子能力比N元素的强,所以氟元素的非金属性比N元素强。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
