题目内容
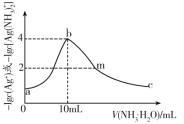
【题目】室温下,在20 mL新制氯水中滴加pH=13的NaOH溶液,溶液中水电离的c(H)与 NaOH溶液体积的关系如图所示。已知:K(HClO)=3×108,H2CO3:Ka1=4.3×107,Ka2=5.6×1011。下列说法正确的是
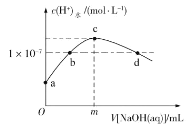
A.m一定等于20
B.b、d点对应的溶液显中性
C.c点溶液中c(Na)=2c(ClO)+2c(HClO)
D.向c点溶液中通入少量CO2:2ClO+H2O+CO2=2HClO+CO32
【答案】C
【解析】
分析题中由水电离的氢离子浓度变化曲线图可知,a~c段水电离出的氢离子浓度逐渐增大,说明这个过程中促进了水的电离,在c~d段水电离出的氢离子浓度逐渐减小,说明此过程中水的电离被抑制。在c点水的电离程度最大,此时溶液中的溶质为:NaCl和NaClO。据此进行判断。
A.NaOH溶液的pH=13,则c(NaOH)=0.1mol·L1,新制氯水的浓度不确定,m不一定等于20,A项错误;
B.由题给信息可知,a点时还未加入NaOH,此时溶液呈酸性,c点中水电离程度最大,此时所得溶液溶质是NaCl和NaClO,溶液呈碱性,故b点溶液呈中性,c~d段水电离出的氢离子浓度逐渐减小,说明随着NaOH的继续加入,水的电离受到抑制,故d点溶液应呈碱性,B项错误;
C.a~c点发生反应为Cl2+2NaOH=NaCl+NaClO+H2O,c(Cl)=c(HClO)+c(ClO),由物料守恒知,c(Na)=c(Cl)+c(HClO)+c(ClO),故c(Na)=2c(ClO)+2c(HClO),C项正确;
D.由电离常数知,电离质子能力:H2CO3>HClO>HCO3-,故H2O+ClO-+CO2= HCO3-+HClO,D项错误;
答案选C。

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目