题目内容
【题目】【化学——选修3:物质结构与性质】
(1)元素的第一电离能:Al________Si(填“>”或“<”)。
(2)基态Mn2+的核外电子排布式为____________。
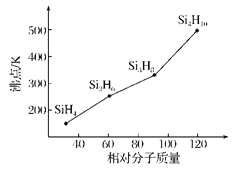
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是________________________。
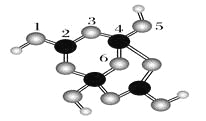
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:
①在Xm-中,硼原子轨道的杂化类型有________;配位键存在于________原子之间(填原子的数字标号);m=________(填数字)。
②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有________ (填序号)。
A离子键 B共价键 C金属键 D范德华力 E氢键
【答案】(1)< (2)1s22s22p63s23p63d5(或[Ar]3d5)
(3)硅烷的相对分子质量越大,分子间范德华力越强(或其他合理答案)
(4)①sp2、sp34,5(或5,4) 2 ②ADE
【解析】试题分析:(1)同周期从左到右第一电离能逐渐增大趋势,ⅡA和ⅤA族则反常,所以铝的第一电离能小硅;
(2)Mn的电子排布式为1s22s22p63s23p63d54s2或[Ar]3d54s2,则基态Mn2+的核外电子排布式为1s22s22p63s23p63d5或[Ar]3d5;
(3)硅烷是分子晶体,结构相似,相对分子质量越大,分子间的范德华力越大,沸点越高,故答案为:因为硅烷都属于分子晶体,而分子晶体的熔沸点随着相对分子质量的增加,范德华力增强,熔沸点升高;
(4)①1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为SP2杂化,4号B形成4个键,则B原子为SP3杂化; B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间;观察模型,可知Xm-是(H4B4O9)m-,依据化合价H为+1,B为+3,O为-2,可得m=2;
②钠离子与Xm-形成离子键,结晶水分子间存在氢键和范德华力,故答案为:ADE。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案

