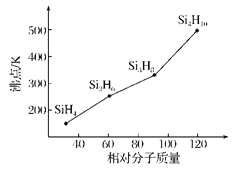
题目内容
【题目】某化学兴趣小组的同学在实验室中用含有铝、铁、铜的废弃合金为主要原料制取硫酸铝溶液、硝酸铜晶体和无水氯化铁,其实验流程如下图所示。

已知:Fe3+沉淀的pH范围为1.9~3.2;Cu2+沉淀的pH范围为4.7~6.7。
请回答下列问题:
(1)写出向合金中加入KOH溶液后所发生反应的离子方程式:__________________,若在该反应中转移0.6NA的电子,则获得标准状况下的气体体积为________L。
(2)下列物质中可作为试剂Z的是_______(填序号)。
A.铜粉 B.氨水 C.氧化铜
加入Z后,调节溶液的pH范围应为________________。
(3)实验操作Ⅰ的顺序依次为____________(填序号)。
A.蒸发浓缩 B.过滤 C.冷却结晶
(4)写出滤渣E与W反应的化学方程式______________________。
【答案】(1)2Al+2OH-+2H2O=2AlO2-+3H2↑(3分)6.72
(2)C;3.2≤pH<4.7(或3.2<pH<4.7)
(3)ACB(4)Fe(OH)3+3HCl=FeCl3+3H2O(3分)
【解析】
试题分析:(1)合金中铝与氢氧化钠溶液反应,发生反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;若在该反应中转移0.6NA的电子,则生成0.3mol氢气,标准状况下的气体体积为6.72L。
(2)试剂Z是调节溶液的pH,由于制备硝酸铜晶体不能引入新杂质,则c只能选择氧化铜,答案选C;调节pH的目的是沉淀铁离子,而不能沉淀铜离子,所以加入Z后,调节溶液的pH范围应为3.2≤pH<4.7。
(3)实验操作Ⅰ的顺序依次为蒸发浓缩、冷却结晶和过滤,答案选ACB;
(4)由于得到氯化铁溶液,所以滤渣E与W反应的化学方程式为Fe(OH)3+3HCl=FeCl3+3H2O。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案