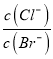题目内容
【题目】如图1所示,A为电源,B为浸透饱和食盐水和酚酞溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液如图2所示.

(1)关闭K1,打开K2,通电后,B中的KMnO4紫红色液滴向c端移动,则电源b端为__极,通电后,滤纸d端的电极反应式是__.
(2)已知C装置中溶液的溶质为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示,则Cu2+、X3+、H+氧化能力由大到小的顺序是__.
(3)D装置中溶液是H2SO4溶液,则电极C端从开始至一段时间后的实验现象是__.
【答案】负2H++2e﹣=H2↑Cu2+>H+>X3+在C端开始时有无色无味气体产生,一段时间后有红色物质析出
【解析】
(1)关闭K1,打开K2,为电解饱和食盐水装置,通电后,B的KMnO4紫红色液滴向c端移动,根据电解池工作原理可知阴离子向阳极移动判断电源的正负极并书写d端的电极反应式;(2)打开K1,关闭K2,则为电解C、D两池,根据电解C的图象可知,开始即析出固体,总共0.2mol电子通过时,析出固体质量达最大,证明此时析出的固体是铜,此后,继续有电子通过,不再有固体析出,说明X3+不放电,H+放电,从而判断离子氧化性;D装置中溶液是H2SO4,电极C端与b负极相连即为阴极,开始氢离子得电子生成氢气,后阳极的铜失电子生成铜离子进入阴极在阴极析出,据此分析可得结论。
(1)据题意B中的KMnO4紫红色液滴向c端移动,说明高锰酸根离子向c端移动,可推出极c端为阳极,则与之相连的电源a端为正极,b端为负极,所以通电滤纸d端为阴极,电极反应式为2H++2e-=H2↑,故答案为:负;2H++2e-=H2↑;
(2)根据电解C的图象可知,通电后就有固体生成,当通过电子为0.2mol时,析出固体质量达最大,证明此时析出的固体是铜.如果是X3+析出,电子数应该是0.3mol,则氧化能力为Cu2+>X3+,当电子超过0.2mol时,固体质量没变,说明这时阴极产生的是氢气,即电解水,说明氧化能力H+>X3+,故答案为Cu2+>H+>X3+;
(3)D装置中溶液是H2SO4,电极C端与b负极相连即为阴极,开始为氢离子得电子生成氢气,后阳极的铜失电子生成铜离子进入阴极在阴极析出,所以看到的现象为在C端开始时有无色无味气体产生,一段时间后有红色物质析出;故答案为:在C端开始时有无色无味气体产生,一段时间后有红色物质析出。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案