题目内容
1.设NA为阿伏加德罗常数,下列说法正确的是( )| A. | 4.6 g NO2与N2O4的混合气体中所含氮原子数为0.1NA | |
| B. | 常温常压下1.6 g甲烷所含共用电子对数为0.1NA | |
| C. | 标准状况下,6.72 L CO2与足量NO2反应转移电子数为0.6NA | |
| D. | 50 mL 98%浓硫酸(密度为1.84 g•cm-3)与足量铜共热,转移的电子数为 0.92NA |
分析 A、NO2与N2O4的最简式均为NO2;
B、求出甲烷的物质的量,然后根据甲烷中含4对共用电子对来分析;
C、求出二氧化碳的物质的量,然后根据当1mol二氧化碳和过氧化钠反应时,反应转移1mol电子来计算;
D、铜只能和浓硫酸反应,和稀硫酸不反应.
解答 解:A、NO2与N2O4的最简式均为NO2,故4.6g混合物中含有的NO2的物质的量为0.1mol,故含0.1NA个氮原子,故A正确;
B、1.6g甲烷的物质的量为0.1mol,而甲烷中含4对共用电子对,故0.1mol甲烷中含0.4NA对共用电子对,故B错误;
C、标况下6.72L二氧化碳的物质的量为0.3mol,而1mol二氧化碳和过氧化钠反应时,反应转移1mol电子,故0.3mol二氧化碳反应时反应转移0.3NA个电子,故C错误;
D、铜只能和浓硫酸反应,和稀硫酸不反应,故浓硫酸不能反应完全,则转移的电子数小于0.92NA个,故D错误.
故选A;
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,题目难度中等.

练习册系列答案
相关题目
15.三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池.工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③增大盐酸的浓度(或将镍废料研成粉末等)等.
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是Na2CO3和NaCl.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05~0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则NH4Cl的浓度最好控制为10 g•L-1.

(6)如果在“沉镍”步骤把Na2CO3改为加草酸,则可以制得草酸镍晶体(NiC2O4•2H2O).草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体.草酸镍晶体受热分解的化学方程式为2NiC2O4•2H2O$\frac{\underline{\;高温\;}}{\;}$Ni2O3+3CO↑+CO2↑+4H2O.

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是Na2CO3和NaCl.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05~0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则NH4Cl的浓度最好控制为10 g•L-1.

(6)如果在“沉镍”步骤把Na2CO3改为加草酸,则可以制得草酸镍晶体(NiC2O4•2H2O).草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体.草酸镍晶体受热分解的化学方程式为2NiC2O4•2H2O$\frac{\underline{\;高温\;}}{\;}$Ni2O3+3CO↑+CO2↑+4H2O.
10. 已知:pKa=-lgKa,25℃时,H2SeO3的 pKa1=1.34,pKa2=7.34.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SeO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )
已知:pKa=-lgKa,25℃时,H2SeO3的 pKa1=1.34,pKa2=7.34.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SeO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )
 已知:pKa=-lgKa,25℃时,H2SeO3的 pKa1=1.34,pKa2=7.34.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SeO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )
已知:pKa=-lgKa,25℃时,H2SeO3的 pKa1=1.34,pKa2=7.34.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SeO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )| A. | a点所得溶液中:2c(H2SeO3)+c(SeO32-)<0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SeO3)+c(H+)=c(SeO32-)+c(OH-) | |
| C. | c点所得溶液中:c(Na+)<3c(HSeO3-) | |
| D. | d点所得溶液中:c(Na+)>c(SeO32-)>c(HSeO3-) |
13.电离平衡常数是衡量弱电解质电离程度的量.已知如表数据(25℃时)
(1)25℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液)的pH由大到小的顺序为Na2CO3溶液>NaCN溶液>CH3COONa溶液.(填写序号)
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
(3)现有浓度为0.02mol/L的HCN与0.01mol/L NaOH等体积混合后,测得C(Na+)>C(CN-),下列关系正确的是BD.
A.C(H+)>C(OH-) B.C(H+)<C(OH-)
C.C(H+)+C(HCN)=C(OH-) D.C(HCN)+C(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理Al3++3HCO3-═Al(OH)3↓+3CO2↑.
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);质子守恒表达式c(OH-)=c(H+)-c(C2O42-)+c(H2C2O4).
A.c(OH-)=c(H+)-c(C2O42-)+c(H2C2O4)
B.c(OH-)+2c(C2O42-)+c(HC2O4-)=c(H+)+c(H2C2O4)+c(Na+)
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO4-+H+→CO2+Mn2++H2O,若将该反应设计成原电池,请写出原电池的负极的电极反应H2C2O4-2e=2CO2+2H+,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为0.2mol.
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
(3)现有浓度为0.02mol/L的HCN与0.01mol/L NaOH等体积混合后,测得C(Na+)>C(CN-),下列关系正确的是BD.
A.C(H+)>C(OH-) B.C(H+)<C(OH-)
C.C(H+)+C(HCN)=C(OH-) D.C(HCN)+C(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理Al3++3HCO3-═Al(OH)3↓+3CO2↑.
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);质子守恒表达式c(OH-)=c(H+)-c(C2O42-)+c(H2C2O4).
A.c(OH-)=c(H+)-c(C2O42-)+c(H2C2O4)
B.c(OH-)+2c(C2O42-)+c(HC2O4-)=c(H+)+c(H2C2O4)+c(Na+)
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO4-+H+→CO2+Mn2++H2O,若将该反应设计成原电池,请写出原电池的负极的电极反应H2C2O4-2e=2CO2+2H+,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为0.2mol.
10.表是元素周期表的一部分,针对表中的①~⑩中10种元素用元素符号或化学式填空回答以下问题:
Ⅰ.填写下列空白:
(1)非金属性最强的元素是F(填元素符号),
(2)写出①与③形成原子个数比为1:1化合物的电子式: ,该化合物酸性条件下与高锰酸钾反应的离子方程式:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
,该化合物酸性条件下与高锰酸钾反应的离子方程式:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
(3)最高价氧化物对应的水化物中碱性最强的是NaOH(填化学式),写出该物质与⑦的最高价氧化物对应的水化物反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
(4)由①②③四种元素中的三种组成的一种强酸,该强酸的稀溶液与铜反应的离子方程式3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图中的变化,其中A是一种淡黄色固体,可作供氧剂,X是一种氢化物,常温下为液体.则:

(1)A与液体X反应的化学方程式:2Na2O2+2H2O=4Na++4OH-+O2↑;
(2)气体Y是一种大气污染物,无色、有刺激性气味的气体,直接排放会形成酸雨.写出气体Y与氯水反应的离子方程式:SO2+Cl2+2H2O═4H++2Cl-+SO42-;
(3)在100mL 18mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积为11.2L(标况下),则反应过程中转移的电子数为NA 或6.02×1023(用“NA”表示)
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
(1)非金属性最强的元素是F(填元素符号),
(2)写出①与③形成原子个数比为1:1化合物的电子式:
 ,该化合物酸性条件下与高锰酸钾反应的离子方程式:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
,该化合物酸性条件下与高锰酸钾反应的离子方程式:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑(3)最高价氧化物对应的水化物中碱性最强的是NaOH(填化学式),写出该物质与⑦的最高价氧化物对应的水化物反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
(4)由①②③四种元素中的三种组成的一种强酸,该强酸的稀溶液与铜反应的离子方程式3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图中的变化,其中A是一种淡黄色固体,可作供氧剂,X是一种氢化物,常温下为液体.则:

(1)A与液体X反应的化学方程式:2Na2O2+2H2O=4Na++4OH-+O2↑;
(2)气体Y是一种大气污染物,无色、有刺激性气味的气体,直接排放会形成酸雨.写出气体Y与氯水反应的离子方程式:SO2+Cl2+2H2O═4H++2Cl-+SO42-;
(3)在100mL 18mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积为11.2L(标况下),则反应过程中转移的电子数为NA 或6.02×1023(用“NA”表示)
10.分子式为C5H12O,不能与金属钠反应放出氢气的有机物共有(不考虑立体异构)( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
 某研究小组欲研究Fe2+的部分性质.
某研究小组欲研究Fe2+的部分性质.
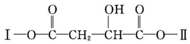 (其中Ⅰ、Ⅱ为未知部分的结构).
(其中Ⅰ、Ⅱ为未知部分的结构).