题目内容
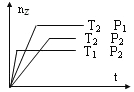
【题目】在200mL含Mg2+、Al3+、NH4+、H+、Cl—等离子的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述正确的是( )

A. 原溶液中n(Mg2+):n(Al3+)=10:1 B. 原溶液中的c(H+)=0.02mol/L
C. x与y的差值为0.008mol D. 原溶液中c(Cl-)=0.6mol/L
【答案】C
【解析】
由图象和溶液中的离子可知,逐滴加入4molL-1的氢氧化钠溶液时,0~4mL发生H+与氢氧化钠的反应,4~30mL发生Mg2+、Al3+与氢氧化钠的反应生成沉淀,30~33mL发生NH4+与氢氧化钠的反应,33~35mL发生Al(OH)3与氢氧化钠的反应,然后进行计算即可解答。
由图象可知,x与y的差值即为Al(OH)3的物质的量,由Al(OH)3+NaOH=NaAlO2+2H2O,NaOH的物质的量为(35-33)mL×10-3L×4molL-1=0.008mol,即Al(OH)3的物质的量也为0.008mol,选项C正确;由Al3+~Al(OH)3,则n(Al3+)=0.008mol,4~30mL发生Mg2+、Al3+与氢氧化钠的反应生成沉淀,共消耗NaOH的物质的量为(30-4)mL×10-3L×4molL-1=0.104mol,Al3+消耗的NaOH的物质的量为0.008mol×3=0.024mol,则与Mg2+反应的NaOH的物质的量为0.104mol-0.024mol=0.08mol,由Mg2++2OH-═Mg(OH)2↓,n(Mg2+)=0.04mol,原溶液中n(Mg2+):n(Al3+)=0.04mol :0.008mol =5:1,选项A错误;0~4mL发生H+与氢氧化钠的反应,则H+的物质的量为4mL×10-3L×4molL-1=0.016mol,c(H+)=![]() =0.08mol/L,选项B错误;溶液中的阴离子只有Cl-,则加入33mLNaOH溶液时Cl-全部存在于NaCl中,则Cl-的物质的量为33mL×10-3L×4molL-1=0.132mol,原溶液中c(Cl-)=
=0.08mol/L,选项B错误;溶液中的阴离子只有Cl-,则加入33mLNaOH溶液时Cl-全部存在于NaCl中,则Cl-的物质的量为33mL×10-3L×4molL-1=0.132mol,原溶液中c(Cl-)=![]() =0.66mol/L,选项D错误;答案选C。
=0.66mol/L,选项D错误;答案选C。