题目内容
1mol甲醛和氢气组成的混合物质量为16g,完全燃烧后的产物通过足量的Na2O2,Na2O2增加的质量为
- A.8g
- B.16g
- C.20g
- D.40g
B
分析:利用差量法,根据化学方程式分析:甲醛与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应.HCHO+O2 CO2+H2O,甲醛与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2
CO2+H2O,甲醛与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2 2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2:H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,可以拓展化学式能改写为(CO)m(H2)n,完全燃烧后产物通过足量的Na2O2,固体增重等于该物质的质量.
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2:H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,可以拓展化学式能改写为(CO)m(H2)n,完全燃烧后产物通过足量的Na2O2,固体增重等于该物质的质量.
解答:甲醛与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应.HCHO+O2 CO2+H2O,甲醛与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2
CO2+H2O,甲醛与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2 2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2:H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,可以拓展化学式能改写为(CO)m(H2)n,完全燃烧后产物通过足量的Na2O2,固体增重等于该物质的质量.
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2:H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,可以拓展化学式能改写为(CO)m(H2)n,完全燃烧后产物通过足量的Na2O2,固体增重等于该物质的质量.
HCHO可以形成CO?H2,故甲醛与氢气混合完全燃烧后产物通过足量的Na2O2,固体增重等于甲醛与氢气的质量之和为16g,
故选B.
点评:本题考查混合物的计算,题目难度较大,本题注意根据反应的化学方程式,从质量守恒的角度解答.
分析:利用差量法,根据化学方程式分析:甲醛与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应.HCHO+O2
 CO2+H2O,甲醛与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2
CO2+H2O,甲醛与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2 2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2:H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,可以拓展化学式能改写为(CO)m(H2)n,完全燃烧后产物通过足量的Na2O2,固体增重等于该物质的质量.
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2:H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,可以拓展化学式能改写为(CO)m(H2)n,完全燃烧后产物通过足量的Na2O2,固体增重等于该物质的质量.解答:甲醛与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应.HCHO+O2
 CO2+H2O,甲醛与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2
CO2+H2O,甲醛与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2 2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2:H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,可以拓展化学式能改写为(CO)m(H2)n,完全燃烧后产物通过足量的Na2O2,固体增重等于该物质的质量.
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2:H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,可以拓展化学式能改写为(CO)m(H2)n,完全燃烧后产物通过足量的Na2O2,固体增重等于该物质的质量.HCHO可以形成CO?H2,故甲醛与氢气混合完全燃烧后产物通过足量的Na2O2,固体增重等于甲醛与氢气的质量之和为16g,
故选B.
点评:本题考查混合物的计算,题目难度较大,本题注意根据反应的化学方程式,从质量守恒的角度解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
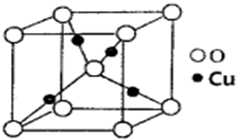 某催化剂中含有的活性组分为Ni、Cu和Zn的化合物,可用于二氧化碳加氢制取甲醚.甲醚是乙醇的同分异构体,其熔点-141.5℃,沸点-24.9℃,在加热条件下可分解成甲烷、乙烷、甲醛等.
某催化剂中含有的活性组分为Ni、Cu和Zn的化合物,可用于二氧化碳加氢制取甲醚.甲醚是乙醇的同分异构体,其熔点-141.5℃,沸点-24.9℃,在加热条件下可分解成甲烷、乙烷、甲醛等.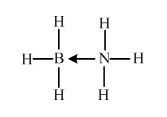
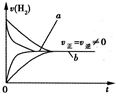 在两个体积均为1L的恒容容器a和b中模拟一碳化学合成甲醛,合成过程中的原理可表示为CO(g)+H2(g)?HCHO(g),其中容器a中使用催化剂.两容器中CO和H2的物质的量相同,均为1mol.试回答下列问题:
在两个体积均为1L的恒容容器a和b中模拟一碳化学合成甲醛,合成过程中的原理可表示为CO(g)+H2(g)?HCHO(g),其中容器a中使用催化剂.两容器中CO和H2的物质的量相同,均为1mol.试回答下列问题: