题目内容
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(2)哪一时间段的反应速率最小
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:A.蒸馏水、B.NaCl溶液、C.NaNO3溶液、D.CuSO4溶液、E.Na2CO3溶液,你认为可行的是
(5)把锌与盐酸的反应设计成原电池,请画出装置示意图,标明正负极,电子流动方向,写出正极的电极反应式
分析:(1)和(2)在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、70mL、112mL、68mL、20mL,生成气体体积越大的时间段,反应速率越大,结合温度、浓度对反应速率的影响分析;
(3)计算出氢气的体积,根据2HCl~H2,计算消耗盐酸的物质的量,计算浓度的变化,根据v=
计算反应速率;
(4)为了减缓反应速率但不减少产生氢气的量,可降低H+浓度,但不能影响H+的物质的量;
(5)根据原电池的构成原理设置装置,书写电极反应式.
(3)计算出氢气的体积,根据2HCl~H2,计算消耗盐酸的物质的量,计算浓度的变化,根据v=
| △c |
| △t |
(4)为了减缓反应速率但不减少产生氢气的量,可降低H+浓度,但不能影响H+的物质的量;
(5)根据原电池的构成原理设置装置,书写电极反应式.
解答:解:(1)和(2)在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、70mL、112mL、68mL、20mL,由此可知反应速率最大的时间段为2~3 min,因反应为放热反应,温度升高,反应速率增大,反应速率最小的时间段是4~5min时间段,此时温度虽然较高,但H+浓度小,
故答案为:2~3 min;该反应是放热反应,此时温度高;4~5 min;此时H+浓度小;
(3)在2~3min时间段内,n(H2)=
=0.005mol,根据2HCl~H2,计算消耗盐酸的物质的量为0.01mol,则υ(HCl)=
=0.1 mol/(L?min),
故答案为:υ(HCl)=0.1 mol/(L?min);
(4)A.加入蒸馏水,H+浓度减小,反应速率减小且不减少产生氢气的量,故A正确;
B.加入Na2SO4溶液,H+浓度减小,反应速率减小且不减少产生氢气的量,故B正确;
C.加入NaNO3溶液,生成NO气体,影响生成氢气的量,故C错误;
D.加入CuSO4溶液,Zn置换出Cu反应速度增大,但影响生成氢气的量,故D错误;
E.加入Na2CO3溶液,消耗H+,H+浓度减小,影响生成氢气的量,故E错误,
故答案为:AB.
(5)把锌与盐酸的反应设计成原电池,可选用铜作正极,锌作负极,盐酸作为电解质溶液,电子由负极流向正极,如图所示: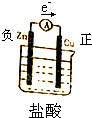 ,氢离子在正极得电子生成氢气,正极电极反应式为:2H++2e-=H2↑,
,氢离子在正极得电子生成氢气,正极电极反应式为:2H++2e-=H2↑,
故答案为: ,2H++2e-=H2↑.
,2H++2e-=H2↑.
故答案为:2~3 min;该反应是放热反应,此时温度高;4~5 min;此时H+浓度小;
(3)在2~3min时间段内,n(H2)=
| 0.112L |
| 22.4L/mol |
| ||
| 1min |
故答案为:υ(HCl)=0.1 mol/(L?min);
(4)A.加入蒸馏水,H+浓度减小,反应速率减小且不减少产生氢气的量,故A正确;
B.加入Na2SO4溶液,H+浓度减小,反应速率减小且不减少产生氢气的量,故B正确;
C.加入NaNO3溶液,生成NO气体,影响生成氢气的量,故C错误;
D.加入CuSO4溶液,Zn置换出Cu反应速度增大,但影响生成氢气的量,故D错误;
E.加入Na2CO3溶液,消耗H+,H+浓度减小,影响生成氢气的量,故E错误,
故答案为:AB.
(5)把锌与盐酸的反应设计成原电池,可选用铜作正极,锌作负极,盐酸作为电解质溶液,电子由负极流向正极,如图所示:
 ,氢离子在正极得电子生成氢气,正极电极反应式为:2H++2e-=H2↑,
,氢离子在正极得电子生成氢气,正极电极反应式为:2H++2e-=H2↑,故答案为:
 ,2H++2e-=H2↑.
,2H++2e-=H2↑.点评:本题考查反应速率的探究和原电池的设计,难度中等.要注意根据把握影响反应速率的因素以及原电池的工作原理.

练习册系列答案
相关题目
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表:
(1)根据上述数据分析,你认为 时间段(指0~1、1~2、2~3、3~4、4~5min,下同)的反应速率最大,收集的氢气最多. 时间段的反应速率最小.
(2)根据上述数据分析,锌与盐酸反应过程中的速率变化是开始时的速率逐渐加快,其影响因素是 .一定时间后反应速率逐渐减慢,其原因是 .
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是(填字母) .
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4.
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(累计值) | 50 | 120 | 232 | 290 | 310 |
(2)根据上述数据分析,锌与盐酸反应过程中的速率变化是开始时的速率逐渐加快,其影响因素是
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是(填字母)
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4.