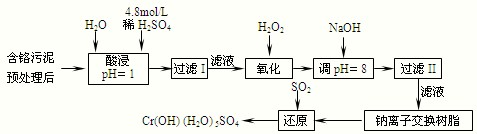
题目内容
(2011?闵行区二模)通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一,对下列实验现象或实操作解释正确的是( )
|
分析:A.氯气氧化碘离子生成碘单质;
B.苯酚与溴水发生取代反应;
C.AgCl也为不溶于酸的白色沉淀;
D.分馏时温度计测定馏分的温度.
B.苯酚与溴水发生取代反应;
C.AgCl也为不溶于酸的白色沉淀;
D.分馏时温度计测定馏分的温度.
解答:解:A.KI淀粉溶液中通入Cl2,溶液变蓝,是因氯气氧化碘离子生成碘单质,碘单质遇淀粉变蓝,故A错误;
B.苯酚中滴加浓溴水,有白色沉淀生成,是因苯酚与浓溴水发生取代反应生成2,4,6-三溴苯酚沉淀,故B错误;
C.某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,硫酸钡、氯化银均不溶于酸,则该溶液中含有SO42?或Ag+,但二者不能同时存在,故C错误;
D.分馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处,温度计测定馏分的温度,则可以较准确得到不同沸点下的馏分,故D正确;
故选D.
B.苯酚中滴加浓溴水,有白色沉淀生成,是因苯酚与浓溴水发生取代反应生成2,4,6-三溴苯酚沉淀,故B错误;
C.某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,硫酸钡、氯化银均不溶于酸,则该溶液中含有SO42?或Ag+,但二者不能同时存在,故C错误;
D.分馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处,温度计测定馏分的温度,则可以较准确得到不同沸点下的馏分,故D正确;
故选D.
点评:本题考查化学实验方案的评价,涉及氧化还原反应、取代反应、离子的检验、分馏实验,综合性较强,注重基础知识的考查,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目