题目内容
【题目】铁、铝及其化合物在生产和生活中有着广泛的应用.
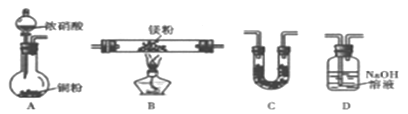
(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护.
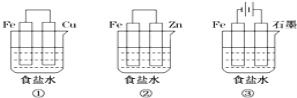
在相同条件下,三组装置中铁电极腐蚀最快的是 (填装置序号),该装置中正极电极反应式为 ;为防止金属Fe被腐蚀,可以采用上述 (填装置序号)装置原理进行防护;装置③中总反应的离子方程式为 。
(2)新型固体LiFePO4隔膜电池广泛应用于电动汽车。电池反应为FePO4 + Li![]() LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向______极移动(填“正”或“负”),负极反应为Li-e— =Li+,则正极反应式为____________。
LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向______极移动(填“正”或“负”),负极反应为Li-e— =Li+,则正极反应式为____________。
【答案】(1)①;(2分)O2+4e-+2H2O=4OH-;(2分)
②③;(2分)2Cl﹣+2H2O![]() H2↑+Cl2↑+2OH﹣;(2分)
H2↑+Cl2↑+2OH﹣;(2分)
(2)正;(2分);FePO4+Li+e-=LiFePO4(2分)
【解析】
试题分析:(1)①装置为原电池,铁为负极,被腐蚀;②装置为原电池,锌为负极被腐蚀,铁做正极被保护;③装置为电解池,铁做阴极被保护。所以在相同条件下,三组装置中铁电极腐蚀最快的是①,该装置中正极反应式为O2+4e-+2H2O=4OH-;为防止金属Fe被腐蚀,可以采牺牲阳极的阴极保护法或外加电流的的阴极保护法,即上述②③装置。装置③中铁被保护,实际是电解饱和食盐水,生成氢氧化钠和氢气和氯气,离子方程式为:2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑。
2OH-+Cl2↑+H2↑。
(2)原电池中阳离子向正极移动,则该电池放电时Li+向正极移动,负极反应为Li-e— =Li+,则根据总反应式可知正极是FePO4 得到电子转化为LiFePO4,正极反应式为FePO4+Li+e-=LiFePO4。

 阅读快车系列答案
阅读快车系列答案【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. A B. B C. C D. D