题目内容
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5则下列有关比较中正确的是( )
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>③=②>①
【答案】
A
【解析】
试题分析:根据原子的基态电子排布可知,①②③分别是S、P、N、F。非金属性越强,第一电离能越大,由于P元素的3p轨道电子分别处于半充满状态,稳定性强,第一电离能大于S元素的,所以选项A正确。B不正确,原子半径应该是②>①>③>④;非金属性越强,电负性越大,则C中电负性应该是④>③>①>②,C错误;F是最强的非金属元素,没有正价,D不正确,答案选A。
考点:考查核外电子排布以及元素周期律的判断
点评:该题是高考中的常见考点,属于基础性试题的考查。试题综合性强,难易适中,在注重对学生基础知识训练和巩固的同时,侧重对学生能力的培养和训练,该题的关键是灵活运用元素周期律以及正确识别核外电子的排布式,并能结合题意灵活运用即可,有利于培养学生的逻辑推理能力,提高学生的应试能力。

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
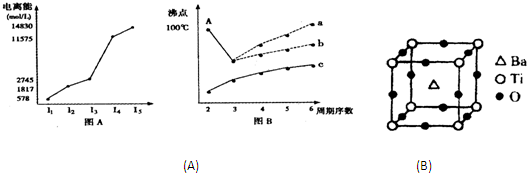
 (1)图表法、图象法是常用的科学研究方法.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第
(1)图表法、图象法是常用的科学研究方法.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第