题目内容
为测定某有机化合物A的结构,通过实验得出以下数据:
①将有机化合物A置于氧气流中充分燃烧,实验测得生成5.4g H2O和8.8g CO2;
②利用质谱仪测定出有机化合物A的相对分子质量为46;
③将9.2g该有机物与足量的金属钠反应,测得在标准状态下产生的氢气为2.24L.
请回答:
(1)有机化合物A中碳原子与氢原子的个数比是 ,A的分子式是 ,A的结构简式为 .
(2)化合物A在一定条件下脱水可生成B,B可合成包装塑料C.A转化为B的化学反应方程式为 ,反应类型为 .
(3)化合物A可在一定条件下通过粮食制得,由粮食制得的A在一定温度下密闭储存,由于发生一系列的化学变化而变得更醇香.在这一系列变化过程中,最后一步化学变化的化学方程式为 ,反应类型为 .
(4)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉.请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,制备反应方程式为 ,反应类型为 .
①将有机化合物A置于氧气流中充分燃烧,实验测得生成5.4g H2O和8.8g CO2;
②利用质谱仪测定出有机化合物A的相对分子质量为46;
③将9.2g该有机物与足量的金属钠反应,测得在标准状态下产生的氢气为2.24L.
请回答:
(1)有机化合物A中碳原子与氢原子的个数比是
(2)化合物A在一定条件下脱水可生成B,B可合成包装塑料C.A转化为B的化学反应方程式为
(3)化合物A可在一定条件下通过粮食制得,由粮食制得的A在一定温度下密闭储存,由于发生一系列的化学变化而变得更醇香.在这一系列变化过程中,最后一步化学变化的化学方程式为
(4)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉.请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,制备反应方程式为
分析:(1)浓硫酸增重为水的质量,碱石灰增重为二氧化碳的质量,以此可确定有机物中C、H原子个数比值;根据有机物与足量的金属钠反应产生氢气,可知物质中含有氧原子,根据讨论法,结合相对分子质量为46以及有机物与氢气的关系可确定分子式与结构简式;
(2)根据乙醇在一定条件下脱水可生成B,B为CH2=CH2,B可合成包装塑料C,C为聚乙烯;
(3)根据乙醇被氧化为乙酸,乙酸与乙醇能发生酯化反应生成酯和水,酯化反应为取代反应;
(4)原子利用率为100%,说明生成物只有一种,可用加成方法制备;
(2)根据乙醇在一定条件下脱水可生成B,B为CH2=CH2,B可合成包装塑料C,C为聚乙烯;
(3)根据乙醇被氧化为乙酸,乙酸与乙醇能发生酯化反应生成酯和水,酯化反应为取代反应;
(4)原子利用率为100%,说明生成物只有一种,可用加成方法制备;
解答:解:(1)n(C)=n(CO2)=
=0.2mol,n(H)=2n(H2O)=
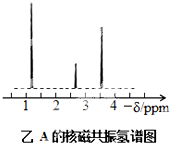
×2=0.6mol,则有机物中N(C):N(H)=0.2mol:0.6mol=1:3;化合物A的相对分子质量为46,若分子中含有一个氧原子,则碳原子与氢原子的个数分别为2、6,为乙醇或二甲醚,n(乙醇):n(氢气)=2:1,符合题意;但二甲醚与钠不反应,不符合题意;若分子中含有2个氧原子,则碳原子与氢原子的个数分别为0.93、2.8,不符合题意,所以化合物A的分子式为C2H6O,结构简式为CH3CH2OH;
故答案为:1:3;C2H6O;CH3CH2OH;
(2)乙醇在一定条件下发生消去反应可生成B,B为CH2=CH2,B可合成包装塑料C,C为聚乙烯,A转化为B的化学反应方程式为:C2H5OH
CH2=CH2↑+H2O;消去反应;
(3)发生一系列的化学变化而变得更醇香,应为乙醇被氧化为乙酸,进而发生酯化反应生成乙酸乙酯,反应的方程式为 ;
;
故答案为: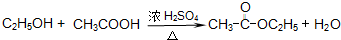 ;消去反应;
;消去反应;
(3)原子利用率为100%,可用加成方法制备,反应的方程式为:CH2=CH2 +HCl
CH3CH2 Cl,
故答案为:CH2=CH2 +HCl
CH3CH2 Cl;加成反应;
| 8.8g |
| 44g/mol |
| 5.4g |
| 18g/mol |
故答案为:1:3;C2H6O;CH3CH2OH;
(2)乙醇在一定条件下发生消去反应可生成B,B为CH2=CH2,B可合成包装塑料C,C为聚乙烯,A转化为B的化学反应方程式为:C2H5OH
| 浓硫酸 |
| 加热 |
(3)发生一系列的化学变化而变得更醇香,应为乙醇被氧化为乙酸,进而发生酯化反应生成乙酸乙酯,反应的方程式为
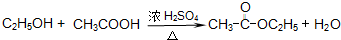 ;
;故答案为:
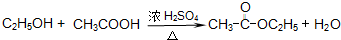 ;消去反应;
;消去反应;(3)原子利用率为100%,可用加成方法制备,反应的方程式为:CH2=CH2 +HCl
| 催化剂 |
故答案为:CH2=CH2 +HCl
| 催化剂 |
点评:本题考查有机物的推断,题目难度不大,注意根据讨论法确定有机物的结构简式为解答该题的关键,注意把握题给信息.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
 为测定某有机化合物A的结构,进行如下实验.
为测定某有机化合物A的结构,进行如下实验.
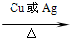 2CH3CHO+2H2O
2CH3CHO+2H2O
 ,
, CH3COOC2H5+H2O,
CH3COOC2H5+H2O, 为测定某有机化合物A的结构,进行如下实验.
为测定某有机化合物A的结构,进行如下实验.