题目内容
下列结论不正确的是
| A.粒子半径:S>S2->Cl- | B.酸性:HClO4>H2SO4>H3PO4 |
| C.金属性:Na>Mg>Al | D.氢化物稳定性:HF>H2O>NH3 |
A
解析试题分析:电子层数越多半径越大,电子层数相同时,半径随原子序数的增大而减小,半径越小其酸性,氧化性,非金属性,稳定性就越强,半径越大其对应的碱性,还原性,金属性,就越强,因此答案选A
考点:考查元素周期律的相关知识点

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
元素X的原子核外M电子层上有3个电子,元素Y的简单阴离子为Y2-,则这两种元素可形成的化合物为
| A.XY2 | B.X3Y2 | C.X2Y3 | D.X2Y |
短周期元素的离子aA3+、bB+、cC2-、dD-具有相同的电子层结构,下列判断正确的是
| A.质子数:d> c>b>a | B.单质的还原性: A>B>D>C |
| C.离子半径:A>B>D>C | D.原子半径:B>A>C>D |
已知X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4。则下列说法不正确的是
| A.气态氢化物的稳定性:HX>H2Y>ZH3 | B.非金属活泼性:Z<Y<X |
| C.单质的氧化性:X2>Y>Z | D.原子最外电子层上的电子数相等 |
短周期元素甲、乙、丙、丁在元素周期表的相对位置如下表所示,其中甲的气态氢化物的水溶液呈碱性,则下列判断正确的是
| 甲 | 乙 | |
| | 丙 | 丁 |
A.甲位于元素周期表中第2周期、第ⅤA族
B.原子半径:甲>乙
C.单质的氧化性:丙>乙
D.气态氢化物稳定性:丁>丙>乙
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
| A.原子半径:A>B>D>C | B.单质的还原性:A>B>D>C |
| C.原子序数:d>c>b>a | D.离子半径:C>D>B>A |
关于原子结构、元素性质的说法正确的是
| A.随原子序数的递增,元素原子的核外电子数增多,原子半径逐渐减小 |
| B.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素 |
| C.Si、P、S、Cl 相应的氧化物对应水化物的酸性依次增强 |
| D.在元素周期表中,各主族元素的最高化合价与其族序数相等 |
目前,医疗上使用放射性核素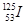 治疗肿瘤,该核素原子核内的中子数与电子数之差是
治疗肿瘤,该核素原子核内的中子数与电子数之差是
| A.125 | B.72 | C.19 | D.53 |