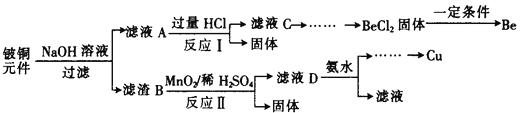
题目内容
【题目】PCl3和Cl2在一定条件下反应生成PCl5。
(1)有88 g CO2与足量H2恰好完全反应,生成气态水和甲醇,可放出1.2014×105 J的热量,试写出该反应的热化学方程式_______________________________________。
(2)25 ℃、101 kPa下,CH4的燃烧热为a kJ/mol,9 g液态水变为水蒸气吸热b kJ,则CH4燃烧生成二氧化碳和水蒸气热化学方程式为________________________________。
(3)硅与氯两元素的单质反应生成1mol硅的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式:________________________________________________。
(4)CO2与CH4经催化重整制得合成气:CH4(g)+ CO2(g) ![]() 2CO (g)+ 2H2(g)已知上述反应中相关的化学键键能数据如下:
2CO (g)+ 2H2(g)已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=________________________________。
(5)利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:___________________________________。
【答案】CO2(g)+3H2(g)=CH3OH(g)+H2O(g);H=-60.07 kJ/mol CH4(g)+2O2(g)===CO2(g)+2H2O(g);H=-(a-4b)kJ/mol Si(s)+2Cl2(g)=SiCl4(l) △H=687 kJ/mol +120 kJ·mol-1 3SO2(g)+2H2O (g)![]() 2H2SO4 (l)+S(s) ΔH2=254 kJ·mol1
2H2SO4 (l)+S(s) ΔH2=254 kJ·mol1
【解析】
(1)88gCO2的物质的量是2mol,2molCO2与足量H2恰好完全反应,生成气态水和甲醇,放出1.2014×105 J的热量,则1molCO2参与反应放热60.07 kJ;(2)25 ℃、101 kPa下,CH4的燃烧热为a kJ/mol,则甲烷燃烧热的热化学方程式是CH4(g)+2O2(g)=CO2(g)+2H2O(l) H= -akJ/mol;9 g液态水变为水蒸气吸热b kJ,则H2O(l)= H2O(g) H= 2b kJ/mol;根据盖斯定律计算CH4燃烧生成二氧化碳和水蒸气的焓变;(3)硅与氯两元素的单质反应生成SiCl4,SiCl4熔、沸点分别为-69℃和58℃,则常温下呈液态,生成1mol 液态SiCl4放热687kJ;(4)焓变=反应物的总键能-生成物的总键能;(5) 反应Ⅱ是3SO2(g)+2H2O (g)![]() 2H2SO4 (l)+S(s),根据盖斯定律计算反应Ⅱ的焓变。
2H2SO4 (l)+S(s),根据盖斯定律计算反应Ⅱ的焓变。
(1)88gCO2的物质的量是2mol,2molCO2与足量H2恰好完全反应,生成气态水和甲醇,放出1.2014×105 J的热量,则1molCO2参与反应放热60.07 kJ;该反应的热化学方程式是CO2(g)+3H2(g)=CH3OH(g)+H2O(g);H= -60.07 kJ/mol;(2)25 ℃、101 kPa下,CH4的燃烧热为a kJ/mol,则甲烷燃烧热的热化学方程式是 ①CH4(g)+2O2(g)=CO2(g)+2H2O(l) H= -akJ/mol;9 g液态水变为水蒸气吸热b kJ,则②H2O(l)= H2O(g) H=2b kJ/mol;根据盖斯定律①-2×②得CH4燃烧生成二氧化碳和水蒸气的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(g);H= -(a-4b) kJ/mol;(3)硅与氯两元素的单质反应生成SiCl4,SiCl4熔、沸点分别为-69℃和58℃,则常温下呈液态,生成1mol 液态SiCl4放热687kJ,热化学方程式为Si(s)+2Cl2(g)=SiCl4(l) △H=687 kJ/mol;(4)焓变=反应物的总键能-生成物的总键能,所以CH4(g)+ CO2(g) ![]() 2CO (g)+ 2H2(g) ΔH=413kJ/mol×4+745kJ/mol×2-1075kJ/mol×2-436kJ/mol×2=+120 kJ·mol-1;(5) ① 2H2SO4(l)
2CO (g)+ 2H2(g) ΔH=413kJ/mol×4+745kJ/mol×2-1075kJ/mol×2-436kJ/mol×2=+120 kJ·mol-1;(5) ① 2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1;②S(s)+O2(g)
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1;②S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1;根据盖斯定律-①-②得反应Ⅱ的热化学方程式为3SO2(g)+2H2O (g)
SO2(g) ΔH3=-297 kJ·mol-1;根据盖斯定律-①-②得反应Ⅱ的热化学方程式为3SO2(g)+2H2O (g)![]() 2H2SO4 (l)+S(s) ΔH2=254 kJ·mol1。
2H2SO4 (l)+S(s) ΔH2=254 kJ·mol1。

【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | α1 (SO2) | α2 (SO3) | α3 (SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A. v1<v2,c2< 2c1 B. K1>K3,p2> 2p3
C. v1<v3,α1(SO2) <α3(SO2) D. c2> 2c3,α2(SO3)+α3(SO2)<1