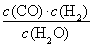题目内容
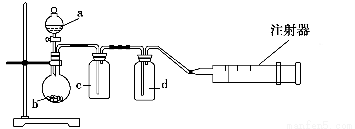
某课外活动兴趣小组欲用下列化学试剂在实验室里制取Cl2并验证Cl2的某些化学性质。实验试剂:3 mol·L-1 H2SO4、1 mol·L-1 NaOH溶液、MnO2、KMnO4、吸收少量SO2的NaOH溶液、浓盐酸、紫色石蕊试液、饱和NaCl溶液、BaCl2溶液、品红溶液。甲小组设计的实验装置图如下,在B中加入吸收少量SO2的NaOH溶液,D中加入1 mol·L-1 NaOH溶液。请回答下列问题:

Ⅰ.(1)写出仪器X的名称:________。
(2)写出A中发生反应的化学方程式:__________________________________,
不能用E装置代替A装置的原因是___________________________________。
(3)C装置的作用是_________________________________________________。
(4)甲小组通过该实验要验证Cl2的________(填“漂白性”、“还原性”或“氧化性”)。
(5)乙小组认为甲小组设计的实验装置有缺陷,请你帮助甲小组完善该装置。即还要在________和________(填“A”、“B”、“C”或“D”)装置间连接一个装有________的洗气装置。
Ⅱ.丙小组认为反应一段时间后,B装置溶液(强碱性)中肯定存在Cl-、OH-和SO,可能还含有其他的阴离子。
请你设计实验帮助丙小组探究该吸收液中可能存在的其他阴离子。
(1)提出合理假设
假设1:只存在________,或只存在________。
假设2:可能两者都________(填“存在”或“不存在”)。
(2)请设计实验验证假设的正确性:___________________________________。
Ⅰ.(1)分液漏斗
(2)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O KMnO4为易溶于水的粉末
(3)完全缓冲,防倒吸 (4)氧化性
(5)A B 饱和食盐水
Ⅱ.(1)ClO- SO32- 不存在
(2)取适量吸收液于两支试管中,向一支试管中加入足量盐酸,若产生能使品红溶液褪色的气体,则有SO32-;向另一支试管中加入盐酸,再加几滴紫色石蕊试液,若溶液先变红后褪色,则有ClO-(其他合理答案也可)
【解析】本题考查物质的制备及性质探究
Ⅰ.(1)仪器X是分液漏斗。(2)A是制备氯气的装置,用高锰酸钾与浓盐酸制备氯气不必加热,而用二氧化锰与浓盐酸制备氯气需要加热,所以A中发生的是高锰酸钾与浓盐酸的反应。高锰酸钾是粉末状固体,所以不能用E代替A。(3)C是缓冲瓶,起防倒吸的作用。(4)由于B中是吸收了少量SO2的NaOH溶液,即含有两种溶质:NaOH和Na2SO3。当氯气通入B溶液中时,氯气将其中的Na2SO3氧化,表现出氧化性。(5)浓盐酸有挥发性,挥发出的HCl气体会与B中溶质发生反应,对氯气与Na2SO3的反应产生干扰。
Ⅱ.(1)氯气与NaOH反应生成NaCl、NaClO,所以吸收液中可能含有ClO-。由于吸收液呈强碱性,所以氯气不足,SO32-可能有剩余。又由于ClO-与SO32-可发生氧化还原反应生成Cl-与SO42-,所以二者可能都没有剩余。(2)如果存在SO32-,加入足量稀盐酸会生成二氧化硫,二氧化硫能使品红溶液褪色;如果存在ClO-,加入足量稀盐酸会生成氯气,紫色石蕊试液遇氯气先变红后褪色。

 阅读快车系列答案
阅读快车系列答案下表为四种溶液的溶质质量分数和物质的量浓度的数值,根据表中数据判断四种溶液中密度最小的是( )。
溶液 | KOH | HNO3 | CH3COOH | HCl |
溶质质量分数w(%) | 56 | 63 | 60 | 36.5 |
物质的量浓度c(mol·L-1) | 14.3 | 13.8 | 10.6 | 11.8 |
A.HCl B.HNO3 C.CH3COOH D.KOH