题目内容
第一题:如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
①原子核对核外电子的吸引力 ②形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ?mol-1):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
(1)通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。 。(2分)
(2)表中X可能为第三周期元素中的 (填元素名称)。Y是周期表中 族元素。
(3)第二周期元素中, (填元素符号)元素原子失去核外第一个电子需要的能量最多。
第二题:现有四组物质的熔点数据如下表:
| A组 | B组 | C组 | D组 |
| 金刚石:3550℃ | Li:181℃ | HF:-83℃ | NaCl:801℃ |
| 硅晶体:1410℃ | Na:98℃ | HCl:-115℃ | KCl:776℃ |
| 硼晶体:2300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 二氧化硅:1723℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
据此回答下列问题:
(1)A组属于 晶体,其熔化时克服的微粒间的作用力是 ;
(2)B组晶体共同的物理性质是 (填序号);
①有金属光泽 ②导电性 ③导热性 ④延展性 ⑤易溶于有机溶剂中
(3)C组HF熔点反常是由于 ;
(4)D组晶体可能具有的性质是 (填序号);
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
第一题:
(1)Li原子失去一个电子后,Li+已形成稳定结构,此时再失去一个电子很困难
(2)Na ⅢA (3)Ne
第二题:
(1)原子;共价键; (2)①②③④
(3)HF分子间形成氢键,其熔化消耗的能量更多 (4)②④

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案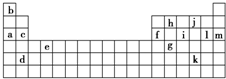 下表是周期表的一部分,表中所列的字母分别代表某一化学元素.
下表是周期表的一部分,表中所列的字母分别代表某一化学元素.
 下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
