题目内容
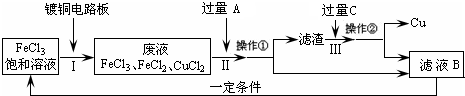
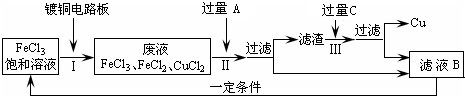
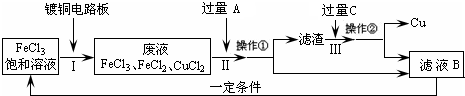
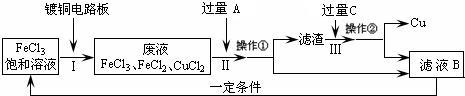
氯化铁能腐蚀铜(2FeCl3+Cu=2FeCl2+CuCl2),工业上常用此原理生产印刷线路板(步骤Ⅰ).从废液中回收铜并得到FeCl3溶液循环利用的主要流程如下: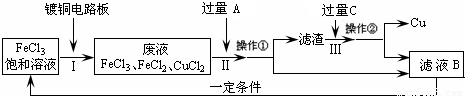
(1)写出步骤Ⅱ中发生反应的离子方程式______.
(2)试剂C是(填名称)______.
(3)若在实验室中完成上述流程,操作①中属于______操作(填名称).
(4)在步骤Ⅲ中加入过量C溶液的目的是______.
【答案】分析:(1)步骤Ⅱ是加入过量铁和氯化铁、氯化铜反应,最终得到氯化亚铁溶液、铁和铜;
(2)试剂C是溶解固体滤渣中的铁,得到的滤液B循环使用,试剂C为盐酸;
(3)操作①是分离溶液和固体,用过滤的方法分离;
(4)步骤Ⅲ中加入过量C盐酸溶液,是充分利用原料,循环使用,分离铁铜混合物.
解答:解:(1)步骤Ⅱ是加入过量铁和氯化铁、氯化铜反应,最终得到氯化亚铁溶液、铁和铜,发生的反应的离子方程式为:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu;
故答案为:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu;
(2)试剂C是溶解固体滤渣中的铁,得到的滤液B循环使用,试剂C为盐酸,故答案为:盐酸;
(3)操作①是分离溶液和固体,用过滤的方法分离,故答案为:过滤;
(4)在步骤Ⅲ中加入过量C溶液的目的是溶解滤渣中的铁生成氯化亚铁溶液,循环使用,故答案为:溶解滤渣中的铁生成氯化亚铁溶液,循环使用.
点评:本题考查了工业生产印刷线路板,从废液中回收铜并得到FeCl3溶液循环利用的原理分析和反应判断,试剂选择是关键,题目较简单.
(2)试剂C是溶解固体滤渣中的铁,得到的滤液B循环使用,试剂C为盐酸;
(3)操作①是分离溶液和固体,用过滤的方法分离;
(4)步骤Ⅲ中加入过量C盐酸溶液,是充分利用原料,循环使用,分离铁铜混合物.
解答:解:(1)步骤Ⅱ是加入过量铁和氯化铁、氯化铜反应,最终得到氯化亚铁溶液、铁和铜,发生的反应的离子方程式为:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu;
故答案为:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu;
(2)试剂C是溶解固体滤渣中的铁,得到的滤液B循环使用,试剂C为盐酸,故答案为:盐酸;
(3)操作①是分离溶液和固体,用过滤的方法分离,故答案为:过滤;
(4)在步骤Ⅲ中加入过量C溶液的目的是溶解滤渣中的铁生成氯化亚铁溶液,循环使用,故答案为:溶解滤渣中的铁生成氯化亚铁溶液,循环使用.
点评:本题考查了工业生产印刷线路板,从废液中回收铜并得到FeCl3溶液循环利用的原理分析和反应判断,试剂选择是关键,题目较简单.

练习册系列答案
相关题目