题目内容
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是 ( )
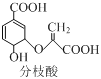
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型不同
C. 1mol分枝酸与足量的Na反应可产生1.5mol H2
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
【答案】C
【解析】
A.分子中含-COOH、-OH、碳碳双键、醚键,共4种官能团,A错误;
B.含-COOH与乙醇发生酯化反应,含-OH与乙酸发生酯化反应,反应类型相同,B错误;
C.羧基、羟基均与钠反应产生氢气,因此1mol分枝酸与足量的Na反应可产生1.5mol H2,C正确;
D.碳碳双键与溴的四氯化碳溶液发生加成反应,双键与-OH均能被酸性高锰酸钾溶液氧化,原理不同,D错误。
答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】下表是25 ℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为_______________________________________。
(2)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=________。
(3)向碳酸钠溶液中滴加少量氯水的离子方程式为_____________________。
(4)若0.1mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(CH3COO-)=_______________mol·L-1(填精确计算结果)。
(5) 将CH3COOH溶液与大理石反应所产生的标况下44.8L气体全部通入到2L 1.5mol/L的NaOH溶液中充分反应,则溶液中所有离子的物质的量浓度由大到小的顺序为__________________________。