题目内容
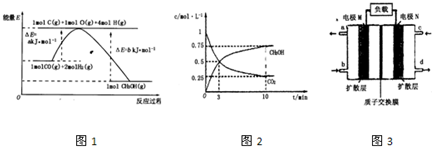
 (2013?泰安二模)用如图所示装置进行实验,下列叙述不正确的是( )
(2013?泰安二模)用如图所示装置进行实验,下列叙述不正确的是( )分析:当K与N连接时,该装置是原电池,铁作负极石墨作正极,负极上铁失电子发生氧化反应,正极上氢离子得电子发生还原反应;当K与M连接时,该装置是电解池,石墨是阳极,铁是阴极,阳极上氯离子放电,阴极上氢离子放电,据此分析解答.
解答:解:A.当K与N连接时,该装置是原电池,铁作负极被腐蚀,故A正确;
B.当K与N连接时,该装置是原电池,石墨作正极,正极上氢离子得电子生成氢气,所以石墨电极产生气泡,故B正确;
C.当K与M连接时,该装置是电解池,阴极上氢离子放电生成氢气,溶液中氢离子浓度降低,所以溶液的pH增大,故C正确;
D.当K与M连接时,石墨电极上的电极反应式为:2Cl--2e-═Cl2↑,故D错误;
故选D.
B.当K与N连接时,该装置是原电池,石墨作正极,正极上氢离子得电子生成氢气,所以石墨电极产生气泡,故B正确;
C.当K与M连接时,该装置是电解池,阴极上氢离子放电生成氢气,溶液中氢离子浓度降低,所以溶液的pH增大,故C正确;
D.当K与M连接时,石墨电极上的电极反应式为:2Cl--2e-═Cl2↑,故D错误;
故选D.
点评:本题考查原电池和电解池原理,明确离子的放电顺序是解本题关键,难度不大.

练习册系列答案
相关题目