题目内容
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为:2KClO3+4HCl(浓)===2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况(单线桥法表示):__________________。
(2)浓盐酸在反应中显示出来的性质是________。(填写编号)
①只有还原性;②还原性和酸性;③只有氧化性;④氧化性和酸性。
(3)产生0.1 mol Cl2,则转移的电子的物质的量为________mol。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的________倍。(ClO2 Cl2还原产物为Cl-)
【答案】
(1)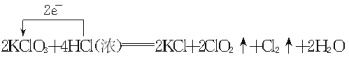
(2)②;(3)0.2;(4)2.63
【解析】
试题分析:(1)KClO3中氯元素化合价,为氧化剂,对应ClO2为还原产物,HCl中Cl元素的化合价升高为还原剂,电子转移的情况如图: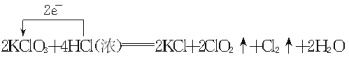 ,故答案为:
,故答案为: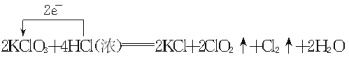 ;
;
(2)反应2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O中,HCl中氯元素化合价由-1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各占一半,故答案为:②;
(3)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,所以产生0.1molCl2,转移的电子的物质的量为0.1mol×2=0.2mol,故答案为:0.2;
(4)假设质量都是mg,ClO2→Cl-得5个电子,Cl2→2Cl-得2个电子,所以ClO2得到的电子的物质的量为![]() ×5=
×5=![]() mol,Cl2得到的电子的物质的量为
mol,Cl2得到的电子的物质的量为![]() ×2=
×2=![]() mol,所以
mol,所以![]() mol:
mol:![]() mol=2.63倍,故答案为:2.63。
mol=2.63倍,故答案为:2.63。

练习册系列答案
相关题目