题目内容
常温下,下列有关物质的量浓度关系正确的是( )
| A.等物质的量浓度的溶液中,水电离出的c(H+):HCl>CH3COOH |
| B.pH相同的溶液中:c(Na2CO3)<c(NaHCO3) |
| C.在Na2SO3溶液中:c(Na+)= 2c(SO32-)+ c(HSO3-)+ c(OH-) |
| D.0.1mol·L-1NaHS溶液中:c(Na+)= c(HS-) |
B
试题分析:HCl是强酸,醋酸是弱酸,等浓度的两种酸氢离子的浓度前者大,因此对水电离的抑制作用较大,因此水电离出的c(H+):HCl<CH3COOH ,A错误;根据越弱越水解的原理,等浓度时碳酸钠的水解程度大于碳酸氢钠,因此若pH相同,则c(Na2CO3)<c(NaHCO3),B正确;C中式子不满足电荷守恒和物料守恒式,C错误;HS-离子发生水解,所以c(Na+)>c(HS-),D错误;故选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
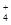 )之和
)之和
 2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法中正确的是
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法中正确的是 H++HO2-,HO2-
H++HO2-,HO2-