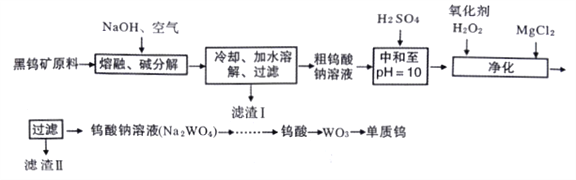
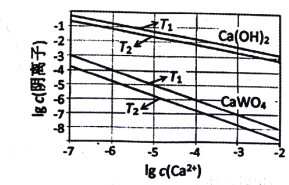
题目内容
【题目】由CO2、H2、CO组成的混合气在同温同压下与氮气的密度相同,则该混合气中CO2、H2、CO的体积比是( )
A. 26:8:1 B. 22:1:14 C. 13:8:7 D. 26:6:17
【答案】C
【解析】
根据CO2、H2和CO碳组成的混合气体在同温、同压下与氮气的密度相同,可知混合气体的平均相对分子质量等于氮气的相对分子质量,即为28,而CO的相对分子质量也为28,则二氧化碳与氢气的平均相对分子质量必须为28,据此进行解答。
CO2、H2和CO组成的混合气体在同温、同压下与N2的密度相同,则混合气体的平均相对分子质量等于氮气的相对分子质量,即为28,由于CO的相对分子质量为28,则CO2和H2的平均相对分子质量为28即可,CO的体积不受限制,利用十字相乘法得二氧化碳和氢气的体积之比:![]() ,则CO2和H2的体积之比为26:16=13:8,CO的体积为任意体积,所以只有选项C符合条件,答案选C。
,则CO2和H2的体积之比为26:16=13:8,CO的体积为任意体积,所以只有选项C符合条件,答案选C。

练习册系列答案
相关题目