题目内容
氨在国民经济中占有重要地位。
(1)工业合成氨时,合成塔中每产生1 mol NH3,放出46.1 kJ的热量。
① 工业合成氨的热化学方程式是 。
② 已知:
N2 (g) 2N
(g)
2N
(g)
H2 (g)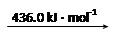 2H
(g)
2H
(g)
则断开1 mol N-H键所需的能量是_______kJ。
(2)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。

① 曲线a对应的温度是 。
② 关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A. 及时分离出NH3可以提高H2的平衡转化率
B. 加催化剂能加快反应速率且提高H2的平衡转化率
C. 上图中M、N、Q点平衡常数K的大小关系是K(M)= K(Q) >K(N)
③ M点对应的H2转化率是 。
 (3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g)。
则该燃料电池的负极反应式是 。
(1)①
N2(g)+ 3H2(g)  2NH3(g),ΔH = —92.2 kJ·mol-1② 391(2)① 200℃;② AC;③ 75%(3)2NH3-6e— + 6OH— = N2
+ 6H2O
2NH3(g),ΔH = —92.2 kJ·mol-1② 391(2)① 200℃;② AC;③ 75%(3)2NH3-6e— + 6OH— = N2
+ 6H2O
【解析】
试题分析:(1)①合成塔中每生成1mol NH3,放出46.1kJ热量,依据热化学方程式写出,标注物质聚集状态和对应反应放出的热量,热化学方程式:N2(g)+3H2(g) 2NH3(g),△H=-92.2kJ/mol;②反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量=3×436+945.8-6×N-H键键能=-92.2,N-H键键能=391kJ(2)合成氨反应为放热反应,反应温度越高越不利于反应的进行,曲线a的NH3的物质的量分数最高,其反应温度应相对最低,故a为200℃
②A、及时分离出NH3可以使平衡正向移动,故A正确;B、催化剂能加快反应速率,但不能改变转化率,故B错误;C平衡常数K与温度有关,与其他条件无关,同一温度下的平衡常数相等,合成氨反应为放热反应,其温度越高平衡常数越小,故C正确;选AC;③在M点NH3的物质的量为60%,剩余物质的量为40%,又n(N2):n(H2)=1:3投料,故剩余H2物质的量为30%,因为N2(g)+3H2(g)
2NH3(g),△H=-92.2kJ/mol;②反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量=3×436+945.8-6×N-H键键能=-92.2,N-H键键能=391kJ(2)合成氨反应为放热反应,反应温度越高越不利于反应的进行,曲线a的NH3的物质的量分数最高,其反应温度应相对最低,故a为200℃
②A、及时分离出NH3可以使平衡正向移动,故A正确;B、催化剂能加快反应速率,但不能改变转化率,故B错误;C平衡常数K与温度有关,与其他条件无关,同一温度下的平衡常数相等,合成氨反应为放热反应,其温度越高平衡常数越小,故C正确;选AC;③在M点NH3的物质的量为60%,剩余物质的量为40%,又n(N2):n(H2)=1:3投料,故剩余H2物质的量为30%,因为N2(g)+3H2(g) 2NH3(g),即发生反应的H2物质的量为90%,故M点对应的H2转化率是
2NH3(g),即发生反应的H2物质的量为90%,故M点对应的H2转化率是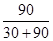 %=75%;(3)原电池中负极失去电子,化合价升高,发生氧化反应,反应式2NH3-6e—+6OH—=N2+6H2O。
%=75%;(3)原电池中负极失去电子,化合价升高,发生氧化反应,反应式2NH3-6e—+6OH—=N2+6H2O。
考点:热化学方程式;化学能与热能的相互转化;化学平衡常数计算;化学电源新型电池;


 2NH3的△H
2NH3的△H