题目内容
2.下列变化或数据与氢键无关的是( )| A. | 水凝结成冰时,密度变小 | |
| B. | 氨分子与水分子形成一水合氨 | |
| C. | 水在2000℃时,只有4%的H2O发生分解 | |
| D. | NH3的沸点比PH3高 |
分析 F、O、N的电负性较强,对应的氢化物分子之间能形成氢键,氢键的存在,影响到物质的某些性质,如熔点、沸点,溶解度、粘度、密度.
解答 解:A、冰和水的密度不同主要是由于水分子间存在氢键,氢键在水液态是使一个水分子与4个水分子相连,而当水凝固时氢键会拉伸水分子 使水分子之间距离增大 体积也就增大了,密度也就小了,故A有关;
B、O、N的电负性较强,对应的氢化物分子之间能形成氢键,所以氨分子与水分子之间能形成氢键,故B有关;
C、水在2000℃时,只有4%的H2O发生分解,是因为水中氧和氢之间的共价键很牢固,不易断裂,所以与氢键无关,故C无关;
D、因为氨分子间有氢键,其沸点升高,所以氨的沸点比同主族元素氢化物的高,故D有关;
故选:C.
点评 本题考查了氢键和共价键知识,侧重于氢键对物质的性质的影响,题目难度不大,学习中注意总结该部分知识.

练习册系列答案
相关题目
13.氨水显弱碱性的主要原因是( )
| A. | 通常状况下,氨的溶解度不大 | B. | 氨水中的NH3•H2O电离出少量OH- | ||
| C. | 溶于水的氨分子只有少量电离 | D. | 氨本身的弱碱性 |
17.下列说法中正确的是( )
| A. | Na2O2分子中所有原子最外层均达到8电子稳定结构 | |
| B. | NH4Cl、MgCl2均为离子化合物,均含有离子键和共价键 | |
| C. | 同周期第ⅠA族元素和第ⅦA族元素之间只能形成离子化合物 | |
| D. | NH4Cl仅由非金属元素组成,所以它是共价化合物 |
7.A元素原子最外层电子数是次外层电子数的3倍,B元素原子次外层是最外层电子数的2倍,则关于A、B元素的判断正确的( )
| A. | A和B元素不一定都是短周期元素 | |
| B. | A和B元素一定是同一主族元素 | |
| C. | A和B元素一定都是非金属元素 | |
| D. | A、B可以相互化合形成化合物BA2或B2A |
14.化合物丙由如下反应得到: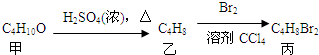 ,丙的结构简式不可能是( )
,丙的结构简式不可能是( )
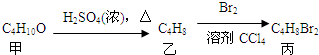 ,丙的结构简式不可能是( )
,丙的结构简式不可能是( )| A. | CH3CH2CHBrCH2Br | B. | CH3CH(CH2Br)2 | C. | CH3CHBrCHBrCH3 | D. | (CH3)2CBrCH2Br |
11.下列反应中,不属于取代反应的是( )
| A. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯 | |
| B. | 在一定条件下苯与氢气反应制环己烷 | |
| C. | 苯与浓硫酸共热制取苯磺酸 | |
| D. | 催化剂存在下,苯与溴反应制溴苯 |
12.下列排列顺序正确的是( )
| A. | 热稳定性:H2O>H2S>SiH4 | B. | 原子半径:Na>N>Al | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 碱性:NaOH>Be(OH)2>Mg(OH)2 |
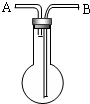 利用如图所示,根据以下8种气体回答:①H2;②O2;③CH4;④HCl;⑤NH3;⑥CO2;⑦H2S;⑧SO2.
利用如图所示,根据以下8种气体回答:①H2;②O2;③CH4;④HCl;⑤NH3;⑥CO2;⑦H2S;⑧SO2.