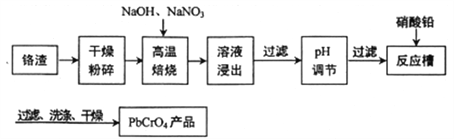
题目内容
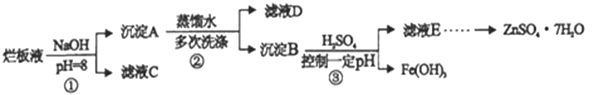
【题目】制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中除含有硝酸锌外,还含有自来水带入的Cl-和Fe3+。在实验室里用“烂板液”制取znSO4·7H2O的过程如下:
(1)若稀硝酸腐蚀锌板时还原产物为NH4NO3,氧化剂与还原剂的物质的量之比是 _________
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠,写出Zn(OH)2被溶解的离子方程式_____________
(3)滤液D中除了含有OH-离子外,还含有的阴离子有_________(填离子符号)。
(4)若滤液E的pH=4, c(Zn2+)=2mol/L,c(Fe3+)=2.6×10-9mol/L能求得的溶度积是____(填选项)
A Ksp[Zn(OH)2] B Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C Ksp[Fe(OH)3]
(5)已知:①Fe(OH)3 (s) ![]() Fe3+(aq)+3OH-(aq) △H=a kJ/mol
Fe3+(aq)+3OH-(aq) △H=a kJ/mol
②H2O (l) ![]() H+(aq)+ OH-(aq) △H=b kJ/mol
H+(aq)+ OH-(aq) △H=b kJ/mol
请写出Fe3+发生水解反应的热化学方程式___________
(6)若Fe(OH)3的溶度积常数为Ksp,H2O 的离子积常数为Kw ,Fe3+发生水解反应的平衡常数K=________。(用含Ksp、Kw的代数式表示)
【答案】1:4 Zn(OH)2+2OH- =[Zn(OH)4]2- Cl- 、 NO3- C Fe3+(aq)+ 3H2O (l) ![]() Fe(OH)3 (s)+3 H+ (aq) △H=(3b-a) kJ/mol
Fe(OH)3 (s)+3 H+ (aq) △H=(3b-a) kJ/mol ![]()
【解析】
“烂板液”中除含硝酸锌外,还含有自来水带入的Cl-和Fe3+,由流程可知,先加NaOH可沉淀锌离子、铁离子,滤液C、D均含硝酸钠、氯化钠,沉淀A洗涤后得到沉淀B,加硫酸控制pH分离出Fe(OH)3,滤液E含ZnSO4,蒸发浓缩、冷却结晶、过滤分离出ZnSO4·7H2O。
(1)若硝酸被还原的产物为NH4NO3,金属锌全部生成硝酸锌,反应可以表达为:4Zn+10HNO3=4 Zn(NO3)2+NH4NO3+3H2O,被还原的硝酸得NH4NO3,有1mol,未被还原的在盐Zn(NO3)2和NH4NO3中,有9mol,氧化剂与还原剂的物质的量之比是1:4;
故答案为:1:4;
(2)Zn(OH)2溶解生成四羟基合锌酸钠,反应的离子方程式为Zn(OH)2+2OH-=[Zn(OH)4]2-,
故答案为:Zn(OH)2+2OH- =[Zn(OH)4]2- ;
(3)固体具有吸附性,沉淀A可吸附溶液中的Cl-、NO3-等离子,则滤液中应含有Cl-、NO3-,
故答案为:Cl-、NO3-;
(4)滤液E的pH=4,得到的沉淀为Fe(OH)3,Fe(OH)3的溶度积常数为Ksp=2.6×10-9×(10-10)3=2.6×10-39,
故答案为:C;
(5)已知:①Fe(OH)3 (s) ![]() Fe3+(aq)+3OH-(aq) △H=a kJ/mol
Fe3+(aq)+3OH-(aq) △H=a kJ/mol
②H2O(l) ![]() H+(aq)+ OH-(aq) △H=b kJ/mol
H+(aq)+ OH-(aq) △H=b kJ/mol
结合盖斯定律可知②×3-①可得:Fe3+发生水解反应的热化学方程式Fe3+(aq)+ 3H2O(l) ![]() Fe(OH)3 (s)+3 H+ (aq) △H=(3b-a) kJ/mol ;
Fe(OH)3 (s)+3 H+ (aq) △H=(3b-a) kJ/mol ;
(6)若Fe(OH)3的溶度积常数为Ksp,H2O的离子积常数为Kw ,根据(5)②×3-①可得:Fe3+(aq)+ 3H2O(l) ![]() Fe(OH)3 (s)+3 H+ (aq) Fe3+发生水解反应的平衡常数K=
Fe(OH)3 (s)+3 H+ (aq) Fe3+发生水解反应的平衡常数K=![]() ,
,
故答案为:![]() 。
。