题目内容
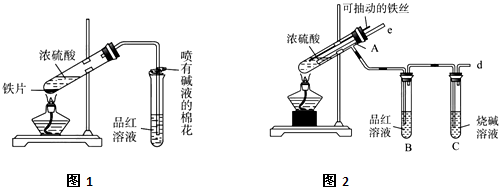
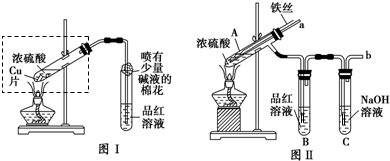
某校化学兴趣小组在探究铁与浓硫酸的反应时,将教材中铜与浓硫酸反应的实验装置(图Ⅰ)改为下图Ⅱ所示的装置。


请回答下列问题:
(1)写出图Ⅰ中虚框处发生反应的化学方程式_________。
(2)图Ⅱ实验装置与图Ⅰ相比较,其优点是:①能更好地吸收有毒气体SO2,防止其污染环境;②_________。
(3)下列对导管a的作用分析中正确的是_________ (填字母)。
A.加热反应过程中,可上下移动导管a,起搅拌作用
B.停止加热,试管内的压强减小,从导管a进入的空气可增大试管A内的压强,防止倒吸
C.停止反应,撤装置之前往导管a中通入空气,可排除装置内的SO2气体,防止其污染环境
(4)反应一段时间后,将试管A取下,然后将试管A中溶液倒入另一盛有适量水的试管D中。该小组同学为确定溶液中所存在的金属离子,进行下列探究过程。
①提出假设:
假设Ⅰ:只含有Fe3+。假设Ⅱ:_________。假设Ⅲ:_________。
②实验设计:
分别取少量试管D中溶液,选用提供的试剂,设计简单的实验检验溶液中所存在的金属离子。请填写下表空白(可以不填满,也可以增加)。
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液。
|
步骤 |
所选试剂 |
现象及结论 |
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
(共12分)
(1)Cu+2H2SO4(浓)  CuSO4+2H2O+SO2↑(2分);
CuSO4+2H2O+SO2↑(2分);
(2)能随开随停,便于控制反应的进行(2分);
(3)BC (2分)
(4) ①假设Ⅱ:只含有Fe2+ (1分)
假设Ⅲ:同时含有Fe2+和Fe3+ (1分)
②(各1分)
|
步骤 |
所选试剂 |
现象、结论 |
|
1 |
KSCN溶液 |
若溶液变红,则含有Fe3+; 若不变红,则不含有Fe3+ |
|
2 |
稀H2SO4、KMnO4溶液 |
若KMnO4溶液褪色,则含有Fe2+;若不褪色,则不含有Fe2+ |
【解析】
试题分析:
(2)铁丝可进可出,便于控制反应的进行。
(3)铁丝可进出,起到搅拌的作用,玻璃导管没有搅拌作用。A错,选BC。
(4) ①若硫酸过量,得Fe3+;铁过量,得Fe2+;若过量一部分,同时含有Fe2+和Fe3+。
②Fe3+和KSCN溶液反应,溶液变红;Fe2+遇KSCN溶液不变红,加KMnO4溶液后,变红。
考点:本题以实验为基础,考查实验现象分析、实验设计等知识。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案(13分)某校化学兴趣小组为探究铁与浓硫酸的反应,设计了图1、图2所示装置进行实验。
(1)比较两个实验装置,图2装置的优点是:
①能更好的吸收有毒气体SO2防止其污染环境;
② 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到”液封”作用阻止SO2气体逸出而防止污染环境;二是 。
(3)能说明有SO2气体产生的实验现象是 。
(4)反应一段时间后,用滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
| A.稀HCl溶液 | B.稀硫酸 | C.KSCN溶液 | D.酸性KMnO4溶液 |
验证Ⅱ:取试样,先滴加少量的 (填试剂序号,下同),振荡,再滴加少量的 ,根据溶液颜色的变化可确定假设Ⅱ是否正确。
验证Ⅲ:步骤1.取试样,滴加少量的 (填试剂序号),溶液的颜色变 色,则试样中含有Fe3+发生反应的离子方程式为 。
步骤2.再取适量的试样滴加少量的 (填试剂序号),溶液颜色的变化为 ,则试样中含有Fe2+。