题目内容
【题目】为验证卤素单质氧化性的相对强弱,某学习小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。实验过程:
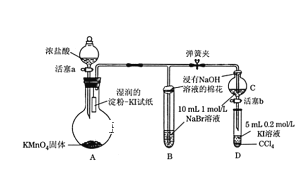
Ⅰ. 打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ. 当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ. 当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
回答问题:
(1)A中产生黄绿色气体,其电子式是_________。实验室在加热条件下制取该气体的离子方程式为____________。
(2)验证氯气的氧化性强于碘单质的实验现象是____________。
(3)C中溶液发生反应的离子方程式是_______________。
(4)过程Ⅲ实验的目的:甲同学认为试管B的作用就是吸收尾气,防止多余Cl2污染空气,因此B中盛装的最佳试剂应该为__________________________
乙同学经分析认为,B中溶液由黄色变为棕红色,发生反应为Cl2+2NaBr=2NaCl+Br2,以此说明C中________,从而得出D中氧化I-的氧化剂必为_______,因此B装置是必不可少的。
(5)过程Ⅳ为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下试管D震荡,静置,观察到的现象为______________,发生反应的离子方程式为_____________________。
(6)氯、溴、碘单质的氧化性逐渐减弱的本质原因:同主族元素从上到下_________,得电子能力逐渐减弱。
【答案】![]() MnO2+4H++2Cl-
MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O 淀粉KI试纸变蓝 Cl2+2Br-=Br2+2Cl- 氢氧化钠溶液 无Cl2,排除Cl2对溴置换碘实验的干扰 Br2 CCl4层溶液变为紫红色 Br2+2I-=I2+2Br - 原子半径逐渐增大
Mn2++Cl2↑+2H2O 淀粉KI试纸变蓝 Cl2+2Br-=Br2+2Cl- 氢氧化钠溶液 无Cl2,排除Cl2对溴置换碘实验的干扰 Br2 CCl4层溶液变为紫红色 Br2+2I-=I2+2Br - 原子半径逐渐增大
【解析】
装置A中高锰酸钾固体与浓盐酸反应生成氯化锰、氯化钾、氯气和水,反应生成的氯气使湿润的淀粉KI试纸变蓝;装置B、C中氯气与溴化钠溶液发生置换反应生成氯化钠和单质溴,浸有氢氧化钠溶液棉花吸收有毒的氯气,防止污染环境;装置D中反应生成的单质溴与碘化钠和四氯化碳混合溶液发生置换反应生成氯化钠和单质碘,震荡,静置,溶液分层,下层溶液变为紫红色,该实验说明氯、溴、碘单质的氧化性逐渐减弱。
(1)A中产生黄绿色气体为氯气,氯气是双原子分子,电子式为![]() ;实验室用二氧化锰与浓盐酸共热反应制备氯气,反应的离子方程式为MnO2+4H++2Cl-
;实验室用二氧化锰与浓盐酸共热反应制备氯气,反应的离子方程式为MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O,故答案为:
Mn2++Cl2↑+2H2O,故答案为:![]() ;MnO2+4H++2Cl-
;MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)装置A中反应生成的氯气使湿润的淀粉KI试纸变蓝,说明氯气与碘化钾发生置换反应生成单质碘和氯化钾,由氧化剂的氧化性大于氧化产物的氧化性可知Cl2的氧化性大于I2的氧化性,故答案为:湿润的淀粉KI试纸变蓝;
(3)装置C中氯气与溴化钠溶液发生置换反应生成氯化钠和单质溴,反应的离子方程式为Cl2+2Br-=Br2+2Cl-,故答案为:Cl2+2Br-=Br2+2Cl-;
(4)氯气能与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,若试管B的作用就是吸收氯气,防止多余Cl2污染空气,则最佳试剂为氢氧化钠溶液;为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,关闭活塞a,则C中无Cl2,排除了Cl2对溴置换碘实验的干扰;由此可知装置D中反应生成的单质溴做氧化剂,与碘化钠和四氯化碳混合溶液发生置换反应生成氯化钠和单质碘,故答案为:氢氧化钠溶液;无Cl2,排除Cl2对溴置换碘实验的干扰;Br2;
(5)装置D中反应生成的单质溴与碘化钠和四氯化碳混合溶液发生置换反应生成氯化钠和单质碘,震荡,静置,溶液分层,下层溶液变为紫红色,反应的离子方程式为Br2+2I-=I2+2Br -,故答案为:CCl4层溶液变为紫红色;Br2+2I-=I2+2Br -;
(6)因同一主族元素,从上到下,电子层数依次增多,原子半径逐渐增大,元素的金属性逐渐增强,得电子能力逐渐减弱,故答案为:原子半径逐渐增大。

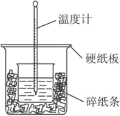
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、量筒、泡沫塑料、泡沫塑料板、胶头滴管、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是______、_______________。他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5mol·L-1HCl溶液 | 20 ℃ | 23.3 ℃ | |
② | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.5 ℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
(2)NaOH用量比HCl用量稍多的原因是_________________________________。
(3)根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: ___________________。
(4)若用KOH代替NaOH,对测定结果________(填“有”或 “无”)影响;若用醋酸代替HCl做实验,对测定结果__________(填“有”或“无”)影响。
(5)两溶液混合后,怎样搅拌溶液_________________________________。