题目内容
【题目】二氧化碳减排和再利用技术是促进工业可持续发展和社会环保的重要措施。将工业废气中的二氧化碳转化为甲醇,其原理是:
CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) △H=-53.7kJ/mol
H2O(g)+CH3OH(g) △H=-53.7kJ/mol
(1) 308K时,向2L密闭容器中通入0.04 mol CO2和0.08 mol H2,测得其压强(p)随时间(t)变化如图1中曲线I所示。


①反应开始至达平衡时,υ(H2)=________;该温度下反应的平衡常数为______mol-2·L2。
②若只改变某一条件,其他条件相同时,曲线变化为II,则改变的条件是____。
(2)还可以通过以下途径实现CO2向CH3OH的转化:
反应I:CO2(g)+H2(g)![]() H2O(g)+CO(g) △H<0
H2O(g)+CO(g) △H<0
反应Ⅱ:2H2(g)+CO(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
反应I和反应Ⅱ的平衡常数K随温度T的变化如图2所示。
①根据图中数据分析可知,T1____T2(填“>”、“<”或“=”);T2时CO2转化为CH3OH的平衡常数K=_______;
②目前,许多国家采用CO2代替CO(以煤和天然气为原料)生产CH3OH,其优点是_________。
(3)用电解法可将CO2转化为多种燃料,原理如图3。铜电极上产生HCOOH的电极反应式为_________。

【答案】0.006mol/(L·min) 104 加入催化剂 < 8 CO以煤和天然气为原料,投资较高,且生产成本受煤和天然气价格影响较大,CO2来源广泛,它还是温室气体,可以解决环境污染 CO2+2e-+2H+=HCOOH
【解析】
(1)①开始时混合气体总物质的量=(0.04+0.08)mol=0.12mol,恒温恒容条件下,气体物质的量之比等于压强之比,则平衡时混合气体总物质的量=![]() ×0.12mol=0.08mol,根据方程式知,如果有3mol氢气完全反应,则混合气体物质的量减少2mol,则混合气体减少(0.12-0.08)mol=0.04mol,则消耗n(H2)=
×0.12mol=0.08mol,根据方程式知,如果有3mol氢气完全反应,则混合气体物质的量减少2mol,则混合气体减少(0.12-0.08)mol=0.04mol,则消耗n(H2)=![]() ×0.04mol=0.06mol,反应开始至达平衡时,υ(H2)=
×0.04mol=0.06mol,反应开始至达平衡时,υ(H2)=![]() 计算;
计算;
利用化学平衡常数的含义计算可逆反应CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g)的化学平衡常数;
H2O(g)+CH3OH(g)的化学平衡常数;
②改变条件时只缩短了反应达到平衡时间,但是平衡时压强不变;
(2)①I、II的正反应都是放热反应,升高温度平衡逆向移动,化学平衡常数减小;
反应Ⅰ:CO2(g)+H2(g)![]() H2O(g)+CO(g)△H<0
H2O(g)+CO(g)△H<0
反应Ⅱ:2H2(g)+CO(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
将方程式I+II可得相应反应的化学平衡常数K与这两个已知反应的化学平衡常数的关系;
②CO需要煤和天然气制取,且生产成本受原料价格影响;二氧化碳是温室气体,还能解决温室效应;
(3)根据图知,Cu作阴极,阴极上二氧化碳得电子和氢离子反应生成HCOOH。
(1)①开始时混合气体总物质的量=(0.04+0.08)mol=0.12mol,恒温恒容条件下,气体物质的量之比等于压强之比,则平衡时混合气体总物质的量=![]() ×0.12mol=0.08mol,根据方程式知,如果有3mol氢气完全反应,则混合气体物质的量减少2mol,则混合气体减少(0.12-0.08)mol=0.04mol,则消耗n(H2)=
×0.12mol=0.08mol,根据方程式知,如果有3mol氢气完全反应,则混合气体物质的量减少2mol,则混合气体减少(0.12-0.08)mol=0.04mol,则消耗n(H2)=![]() ×0.04mol=0.06mol,反应开始至达平衡时,υ(H2)=
×0.04mol=0.06mol,反应开始至达平衡时,υ(H2)=![]() =0.006mol/(L·min);
=0.006mol/(L·min);
可逆反应CO2(g) + 3H2(g)![]() H2O(g)+CH3OH(g)
H2O(g)+CH3OH(g)
开始(mol)0.04 0.08 0 0
消耗(mol)0.02 0.06 0.02 0.02
平衡(mol)0.02 0.02 0.02 0.02
化学平衡常数K=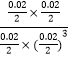 =104L2/mol2;
=104L2/mol2;
②改变条件时只缩短了反应达到平衡时间,但是平衡时压强不变,催化剂只改变化学反应速率不影响平衡移动,所以改变的条件是加入催化剂;
(2)①I、II的正反应都是放热反应,升高温度平衡逆向移动,化学平衡常数减小,根据图知,从左向右化学平衡常数依次减小说明温度依次升高,所以T1<T2;
反应Ⅰ:CO2(g)+H2(g)![]() H2O(g)+CO(g)△H<0
H2O(g)+CO(g)△H<0
反应Ⅱ:2H2(g)+CO(g)![]() CH3OH(g)△H<0
CH3OH(g)△H<0
将方程式I+II得CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g),化学平衡常数K=K1·K2=4×2=8;
H2O(g)+CH3OH(g),化学平衡常数K=K1·K2=4×2=8;
②CO需要煤和天然气制取,投资较高,且生产成本受煤和天然气价格影响较大;二氧化碳来源广泛,且是温室气体,还能解决温室效应,所以用二氧化碳较好;
(3)根据图知,Cu作阴极,在阴极上CO2得电子和氢离子反应生成HCOOH,电极反应式为CO2+2e-+2H+=HCOOH。

【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标准状况),实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(1)在0~1 min、1~2 min、2~3 min、3~4 min、4~5 min时间段中,反应速率最大的时间段是________,原因为______________________;反应速率最小的时间段是________,原因为__________________________。
(2)在2~3 min内,用盐酸的浓度变化表示的反应速率为________。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液,其中可行的是________。
A.蒸馏水 B.Na2SO4溶液
C.NaNO3溶液 D.Na2CO3溶液




