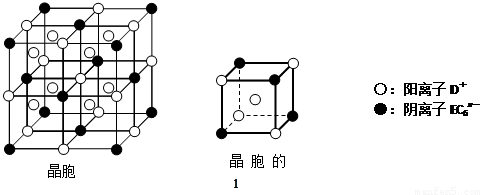
题目内容
(10分)A、B、C、D、E、F、G七种元素的原子序数依次递增。已知:
①G的原子序数为29,其余的均为短周期主族元素;
②A是宇宙中含量最多的元素,B原子最外层电子数是次外层电子数的2倍,C原子核外有三个未成对电子;
③D和E原子价电子排布式均为ns2np4;④F的单质是黄绿色气体。
请回答下列问题:
(1)G2+的核外电子排布式是 。在[G(NH3)4]2+离子中,G2+与NH3分子形成的是 键。
(2)与B、C形成的阴离子(BC—)互为等电子体的微粒有 、 (分子和离子各写一种)。
(3)B与C形成的化合物中,下列判断正确的是 。
a.氢化物稳定性:B>C b.氢化物沸点:B<C
c.最高价氧化物的水化物酸性:B<C d.非金属性:B>C
(4)B、C、D第一电离能由小到大的顺序为 (用元素符号作答),B的一种氢化物相对分子质量为26,分子中的σ键与π键数目比为 。
(5)七种元素中,电负性最大的元素与B元素形成化合物电子式为 ,该物质的晶体属于 。
(第三问2分,其余每空1分) (1)1s22s22p63s23p63d9 配位
(2)N2、CO、C22-、O22+、NO+等
(3)bc (4)C<O<N 3:2 (5) 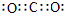 分子晶体
分子晶体
【解析】
试题分析:G的原子序数为29,则G是铜。A是宇宙中含量最多的元素,所以A是O。B原子最外层电子数是次外层电子数的2倍,则B是碳元素。F的单质是黄绿色气体,因此F是Cl。D和E原子价电子排布式均为ns2np4,所以根据原子序数大小可知,D是O,E是S。又因为C原子核外有三个未成对电子,所以C是N。
(1)根据构造原理可知,G2+的核外电子排布式是1s22s22p63s23p63d9;铜离子和氨气分子能形成配位键。
(2)价电子数和原子数分别都相等的是等电子体,因此与B、C形成的阴离子CN—互为等电子体的微粒有N2、CO、C22-、O22+、NO+等。
(3)非金属性压强,氢化物的稳定性越强。氮元素的非金属性强于碳元素的,所以氢化物稳定性是B<C,a和d都不正确;氨气分子间存在氢键,沸点高于甲烷的,b正确;非金属性压强,最高价氧化物的水化物的酸性越强,c正确,答案选bc。
(4)非金属性越强,第一电离能越大。但由于氮元素的2p轨道电子属于半充满状态,稳定性强,所以第一电离能大小顺序是C<O<N。相对分子质量为26的碳元素的氢化物是乙炔,分子中含有碳碳三键。单键都是σ键,三键是由1个σ键和2个π键构成的,所以乙炔分子中的σ键与π键数目比为3:2。
(5)七种元素中,电负性最大的元素是氧元素,和碳元素形成的化合物是CO2,含有极性键,电子式是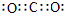
,该物质的晶体属于分子晶体。
考点:考查元素周期表的结构、核外电子的排布、等电子体、第一电离能、电负性、电子式以及晶体类型的有关判断
点评:该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。本题基础性较强,重点突出,难度不大。