题目内容
下列说法中正确的是( )
| A、CO2、BF3、PCl3分子中所有原子的最外层电子都满足8电子稳定结构 |
| B、P4和CH4都是正四面体分子且键角都为109°28ˊ |
| C、乙烯分子有5个σ键,1个π键 |
| D、丙烯分子中3个碳原子都是sp3杂化 |
考点:键能、键长、键角及其应用,共价键的形成及共价键的主要类型,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:A、BF3分子中B原子的最外层电子是6电子结构;
B、P4是正四面体分子但键角都为60°;
C、单键为σ键,双键含有含有1个σ键和1个π键;
D、丙烯分子中甲基碳原子是sp3杂化,另2个碳原子是sp2杂化;
B、P4是正四面体分子但键角都为60°;
C、单键为σ键,双键含有含有1个σ键和1个π键;
D、丙烯分子中甲基碳原子是sp3杂化,另2个碳原子是sp2杂化;
解答:
解:A、BF3分子中B原子的最外层电子是6电子结构,F原子的最外层电子是8电子稳定结构,故A错误;
B、CH4是正四面体分子,键角都为109°28ˊ,P4是正四面体分子但键角都为60°,故B错误;
C、乙烯分子中有1个C=C和4个C-H,所以乙烯分子有5σ键和1个π键,故C正确;
D、丙烯分子中甲基碳原子是sp3杂化,另2个碳原子是sp2杂化,故D错误;
故选C.
B、CH4是正四面体分子,键角都为109°28ˊ,P4是正四面体分子但键角都为60°,故B错误;
C、乙烯分子中有1个C=C和4个C-H,所以乙烯分子有5σ键和1个π键,故C正确;
D、丙烯分子中甲基碳原子是sp3杂化,另2个碳原子是sp2杂化,故D错误;
故选C.
点评:本题考查了8电子结构的判断、有机化合物中共价键的类型,原子的杂化方式,难度不大,注意基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列反应中,水既不做氧化剂又不做还原剂的氧化还原反应是( )
A、C+H2O
| ||||
B、2H2O
| ||||
| C、Na2O+H2O═2NaOH | ||||
| D、3NO2+H2O═2HNO3+NO |
对原子核外电子以及电子的运动,下列描述正确的是( )
①可以测定某一时刻电子所处的位置②电子质量很小且带负电荷③运动的空间范围很小④高速运动⑤有固定的运动轨道⑥电子的质量约为氢离子质量的
.
①可以测定某一时刻电子所处的位置②电子质量很小且带负电荷③运动的空间范围很小④高速运动⑤有固定的运动轨道⑥电子的质量约为氢离子质量的
| 1 |
| 1836 |
| A、①②③ | B、②③④⑥ |
| C、③④⑤⑥ | D、⑤⑥ |
某些资源在自然界中的含量很低,因此从自然界中获取这些资源的一个重要步骤就是富集,下列选项中流程的主要目的不是富集的是( )
A、金沙(Au)
| |||||||||
B、沙子(SiO2)
| |||||||||
C、浓缩海水(Br-)
| |||||||||
D、浓缩海水(Mg2+)
|
下列物质与乙烯互为同系物的是( )
| A、CH3-CH═CH-CH3 |
| B、CH2═CH-CH═CH2 |
| C、CH2═CH-CHO |
| D、C6H5-CH═CH2 |
如图是4个碳原子相互结合而成的3种有机物的碳架结构(氢原子没有画出)三种有机物之间的关系是( )
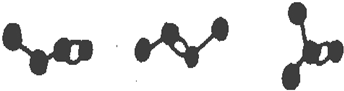

| A、同位素 | B、同系物 |
| C、同素异形体 | D、同分异构体 |
下列化学用语书写正确的是( )
| A、次氯酸的电离方程式:HClO=H++ClO- |
| B、铝溶于烧碱溶液的离子方程式:Al+2OH-=AlO2-+H2↑ |
| C、电解精炼铜的阴极反应式:Cu-2e-=Cu2+ |
| D、已知中和热为57.3kJ?mol-1,稀硫酸与氢氧化钠稀溶液反应的热化学方程式:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l)△H=-114.6kJ?mol-1 |
下列表示对应化学反应的离子方程式正确的是( )
A、MnO2与浓盐酸反应制Cl2:MnO2+4HCl
| ||||
| B、Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | ||||
| C、Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | ||||
| D、明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ |
根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为( )
| A、直线形 sp杂化 |
| B、三角形 sp2杂化 |
| C、三角锥形 sp2杂化 |
| D、三角锥形 sp3杂化 |