题目内容
下列化学用语书写正确的是( )
| A、次氯酸的电离方程式:HClO=H++ClO- |
| B、铝溶于烧碱溶液的离子方程式:Al+2OH-=AlO2-+H2↑ |
| C、电解精炼铜的阴极反应式:Cu-2e-=Cu2+ |
| D、已知中和热为57.3kJ?mol-1,稀硫酸与氢氧化钠稀溶液反应的热化学方程式:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l)△H=-114.6kJ?mol-1 |
考点:电离方程式的书写,离子方程式的书写,热化学方程式
专题:化学用语专题
分析:A.次氯酸,为一元弱酸,部分电离出氢离子和次氯酸根离子,用可逆符号;
B.方程式左右电荷不守恒;
C.金属铜的电解精炼过程中阴极上铜离子得电子;
D.依据中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式.
B.方程式左右电荷不守恒;
C.金属铜的电解精炼过程中阴极上铜离子得电子;
D.依据中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式.
解答:
解:A.次氯酸,为一元弱酸,部分电离,电离方程式:HClO?H++ClO-,故A错误;
B.Al与烧碱反应生成偏铝酸钠和氢气,反应为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故B错误;
C.金属铜的电解精炼过程中,阴极上铜离子得电子生成Cu,其电极反应式为:Cu2++2e-=Cu,故C错误;
D.强酸强碱的中和热为-57.3kJ/mol,中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,
H2SO4(aq)+NaOH(aq)═
Na2SO4(aq)+H2O(l)△H=-57.3 kJ?mol-1;稀硫酸和稀氢氧化钠溶液反应生成2H2O的热化学方程式为:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l)△H=-114.6kJ?mol-1,故D正确;
故选D.
B.Al与烧碱反应生成偏铝酸钠和氢气,反应为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故B错误;
C.金属铜的电解精炼过程中,阴极上铜离子得电子生成Cu,其电极反应式为:Cu2++2e-=Cu,故C错误;
D.强酸强碱的中和热为-57.3kJ/mol,中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,
| 1 |
| 2 |
| 1 |
| 2 |
故选D.
点评:本题主要考查电离方程式的书写、离子方程式、电极反应式、热化学方程式的书写,考查全面,平时注重基础是解答关键,题目难度较易.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
氧氟沙星是常用抗菌药,其结构简式为:

下列对氧氟沙星叙述错误的是( )

下列对氧氟沙星叙述错误的是( )
| A、能发生加成、取代反应 |
| B、能发生还原、酯化反应 |
| C、分子内共有19个氢原子 |
| D、分子内共平面的碳原子多于6个 |
下列说法中正确的是( )
| A、CO2、BF3、PCl3分子中所有原子的最外层电子都满足8电子稳定结构 |
| B、P4和CH4都是正四面体分子且键角都为109°28ˊ |
| C、乙烯分子有5个σ键,1个π键 |
| D、丙烯分子中3个碳原子都是sp3杂化 |
下列说法正确的是( )
| A、ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| B、ⅣA族元素的氢化物中,稳定性最好的是CH4 |
| C、同周期非金属氧化物对应的水化物的酸性从左到右依次增强 |
| D、第三周期元素的离子半径从左到右逐渐减小 |
原子M层有一个未成对P电子的元素种类是( )
| A、1种 | B、2种 | C、3种 | D、4种 |
下列各组离子可以在溶液中大量共存的是( )
| A、Na+、Ba2+、NO3-、SO42- |
| B、NH4+、K+、Cl-、OH- |
| C、K+、H+、NO3-、HCO3- |
| D、K+、OH-、Cl-、AlO2- |
元素周期表中铋元素的数据见图,下列说法不正确的是( )


| A、Bi原子s轨道的形状是球形的,p轨道的形状是纺锤形 |
| B、Bi元素的相对原子质量是209.0 |
| C、Bi原子6p能级中6px、6py、6pz轨道上各有一个电子 |
| D、Bi原子最外层有5个能量相同的电子 |
下列物质属于同分异构体的一组是( )
| A、淀粉和纤维素 |
B、CH3-CH2-CH2-CH3 与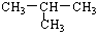 |
| C、1H 和2H |
| D、O2与O3 |