题目内容
【题目】二氧化碳是引起“温室效应”的主要物质,应该减少二氧化碳的排放。
(1)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-a kJmol-1;
CH3OH(g)═CH3OH(l)△H=-b kJmol-1;
2H2(g)+O2(g)═2H2O(g)△H=-c kJmol-1;
H2O(g)═H2O(l)△H=-d kJmol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_______________。
(2)在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H<0,测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。
CH3OH(g)+H2O(g)△H<0,测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。
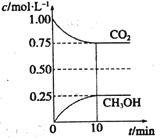
①从0min到10min,v(H2)=______。
②下列措施中能使![]() 增大的是______(选3填编号)。
增大的是______(选3填编号)。
A.升高温度 B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离 D.恒温恒容再充入2mol CO2和3mol H2
③计算该温度下此反应的平衡常数K=______(填分数或保留两位有效数字)。若改变______条件(填编号),可使K=1。
A.增大压强 B.增大反应物浓度 C.降低温度 D.升高温度 E.加入催化剂
(3)某甲醇燃料电池原理如图1所示
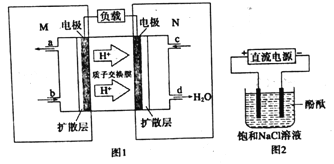
①则M区发生的电极反应式为______。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极).则该电解反应的总反应的离子方程式为:__________________。
假设溶液体积为300mL,当溶液的pH值为13时(在室温下测定),理论上消耗甲醇的质量为______(忽略溶液体积变化)。
【答案】(1)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=![]() (2分);
(2分);
(2)①0.075mol/(L·min)(2分)②CD(1分);③0.20(2分);C(1分);
(3)①CH3OH-6e-+H2O=CO2+6H+(2分);
②2Cl-+2H2O![]() H2↑+Cl2↑+2OH-(2分);0.16g(2分)。
H2↑+Cl2↑+2OH-(2分);0.16g(2分)。
【解析】(1)-[③×3/2+④×2-①-②]得:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=![]() 。
。
(2)①从0min到10min,v(H2)=3 v(CO2)=3×(1-0.75)/10=0.075mol/(L·min).
②使![]() 增大, 就是平衡右移,升高温度平衡左移,恒温恒容下充入He(g),平衡不移动,将H2O(g)从体系中分离,平衡右移,恒温恒容再充入2mol CO2和3mol H2,是增大压强平衡右移,故选C、D。
增大, 就是平衡右移,升高温度平衡左移,恒温恒容下充入He(g),平衡不移动,将H2O(g)从体系中分离,平衡右移,恒温恒容再充入2mol CO2和3mol H2,是增大压强平衡右移,故选C、D。
③该温度下平衡时各物质的浓度为:c(CO2)=0.75mol/L、c(CH3OH)=0.25mol/L、c(H2)=0.75mol/L、c(H2O)=0.25mol/L,平衡常数K=0.25×0.25/[0.75×0.753]=0.20,使K=1,平衡常数增大,平衡右移,增大压强、增大反应物浓度、加入催化剂不影响平衡常数,可以降低温度,选C。
(3)①根据甲醇燃料电池原理图,可判断是酸性电池,M是负极,电极反应式为CH3OH-6e-+H2O=CO2+6H+,②电解饱和食盐水的总反应的离子方程式为:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-;假设溶液体积为300mL,当溶液的pH值为13时,生成OH-为0.03mol,转移电子是0.03mol,消耗甲醇0.005mol,质量为0.005×32=0.16g。
H2↑+Cl2↑+2OH-;假设溶液体积为300mL,当溶液的pH值为13时,生成OH-为0.03mol,转移电子是0.03mol,消耗甲醇0.005mol,质量为0.005×32=0.16g。

【题目】25℃时,三种酸的电离平衡常数如下表所示。
化学式 | CH3COOH | HClO | H3PO3 |
名称 | 醋酸 | 次氯酸 | 亚磷酸 |
电离平衡常数 | 1.8×10-5 | 3.0×10-8 | K1=8.3×10-3 K2=5.6×10-6 |
回答下列问题:
(1)浓度均为0.1mol/L的CH3COOH、HClO、 H3PO3溶液中,c(H+)最小的是__________。
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性。H3PO3的电离方程式为___________。Na2HPO3是________(填“酸式盐”“碱式盐”或“正盐”)。
(3)常温下,0.1mol/L的CH3COOH溶液加水稀释的过程中,下列表达式的数值一定变大的是_______(填字母)。
A.c(H+) B.![]() C.c(CH3COO- ) D.c(CH3COOH)
C.c(CH3COO- ) D.c(CH3COOH)
(4)体积均为10mL、c(H+)均为10-2mol/L的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中c(H+)的变化如图所示,则HX的电离平衡常数_________(填“大于”“小于”或“等于”)醋酸的电离平衡常数。

