题目内容
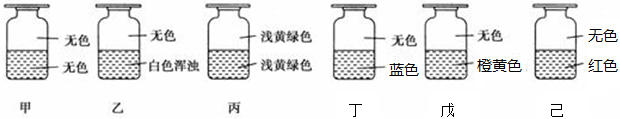
将Cl2与SO2混合均匀后,分别通入到少量下列溶液中,溶液颜色一定会褪去的是
| A.I2与淀粉混合溶液 | B.KMnO4溶液 | C.品红溶液 | D.紫色石蕊试剂 |
C
试题分析:当Cl2与SO2 1:1混合后通入溶液能够发生反应,Cl2+SO2+2H2O=H2SO4+2HCl,当Cl2过量,在溶液中能够与水继续反应,生成盐酸和次氯酸,次氯酸具有氧化性;当SO2过量时,能够与水反应生成亚硫酸,亚硫酸具有漂白性。A选项,I2与淀粉混合溶液呈蓝色,若SO2过量,I2与SO2发生氧化还原反应,蓝色褪去;但Cl2过量则不能发生。B选项,若SO2过量,KMnO4能与其发生氧化还原反应,但Cl2过量则不能发生。C选项正确,若Cl2过量,产生的次氯酸能够使品红褪色,若SO2过量,产生的亚硫酸同样能使品红褪色。D选项,Cl2过量紫色石蕊试剂为红色。故本题选择C选项。

练习册系列答案
相关题目


 。
。