题目内容
(10分,每空2分)决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离如下表所示:
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
578 |
1 817 |
2 745 |
11 578 |
|
B |
738 |
1 451 |
7 733 |
10 540 |
A通常显____价,A的电负性__ __B的电负性(填“>”、“<”或“=”)。
(2)已知:波长为300 nm的紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:
。
|
共价键 |
C—C |
C—N |
C—S |
|
键能/kJ·mol-1 |
347 |
305 |
259 |
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是________________。
(4)某配合物的分子结构如图所示,其分子内不含有__________(填字母)。
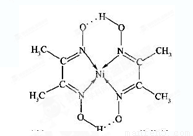
A.离子键 B.共价键
C.金属键 D.配位键 E.氢键
.(1)+3
(2)紫外光具有的能量比蛋白质分子中重要的化学键C—C、C—N和C—S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子
(3)CrO2 (4)AC
【解析】(1)A的第四电离能远大于第三电离能,所以A是第三周期的Al,显+3价。B是镁,金属性越强,电负性越小,所以A的电负性大于镁的。
(2)根据键能可知,紫外光具有的能量比蛋白质分子中重要的化学键C—C、C—N和C—S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子。
(3)离子型氧化物V2O5和CrO2中,金属阳离子含未成对电子分别是0和2,所以适合作录音带磁粉原料的是CrO2 。
(4)根据组成元素可知,全部都是非金属,所以没有离子键和金属键,答案选AC。

 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:


