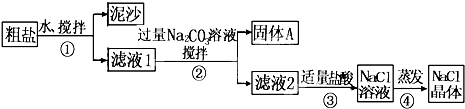
题目内容
| |||||||||||||||||||||||||||||||||
解析:
(1) |
食盐中混有的不溶性泥沙,可以采用物理方法(如溶解、过滤、蒸发)除去. |
(2) |
回答此问题,同学们一定要选准试剂:CaCl2可用Na2CO3溶液沉淀、MgCl2可用NaOH溶液沉淀、硫酸盐可用BaCl2溶液沉淀.为了确保无杂质离子存留,加入的每一种试剂都要过量,且Na2CO3溶液必须加在BaCl2溶液之后,最后加盐酸调节溶液的pH. |
(3) |
答案:①玻璃棒 漏斗 烧杯 铁架台 ②玻璃棒放在漏斗上方是错误的,应靠在有三层滤纸的过滤器上 漏斗下端没有紧靠烧杯内壁,应将其紧靠烧杯内壁 讲析:过滤器由漏斗和滤纸组成,在操作中还需要用到烧杯、铁架台、铁圈、玻璃棒等仪器;过滤操作的要点是“一贴、二低、三靠”,即滤纸紧贴漏斗内壁;滤纸低于漏斗边缘,液面低于滤纸边缘;烧杯紧靠玻璃棒,玻璃棒紧靠三层滤纸,漏斗下端紧靠烧杯内壁. 点评:该题从提纯步骤、反应原理、仪器构成、错误操作等多个角度考查了粗盐的提纯和精制.纵观各地对此知识点的考查,难度一般.同学们只要掌握基本的实验操作原理及步骤,明确注意事项,然后针对问题具体回答即可. |


(1)步骤①和②的操作名称是______.
(2)步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止______,当蒸发皿中有较多量固体出现时,应______.
(3)根据相关知识,完成相关猜想和验证,将下表中空白部分补充完整
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3等物质 | 取少量固体A于试管中,滴加稀盐酸,并用蘸有澄清石灰水的小烧杯罩于试管口 | ______ | 猜想Ⅰ成立 |
| 猜想Ⅱ:最后制得的NaCl固体中仍含有少量Na2SO4 | 取少量NaCl晶体溶于试管中加入少量蒸馏水溶解,______ ______ | ______ | 猜想Ⅱ成立 |