题目内容
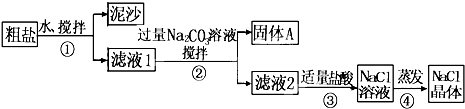
从海水得到的粗盐含有少量的CaCl2、MgSO4等杂质,某同学用粗盐进行提纯,获取纯净的食盐,实验步骤如图所示.请回答:
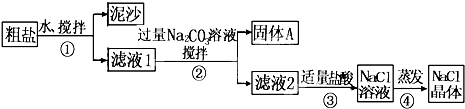
(1)步骤①和②的操作名称是
(2)步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止
(3)根据相关知识,完成相关猜想和验证,将下表中空白部分补充完整

(1)步骤①和②的操作名称是
过滤
过滤
.(2)步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止
溶液受热不均,造成液体飞溅
溶液受热不均,造成液体飞溅
,当蒸发皿中有较多量固体出现时,应移去酒精灯,用余热将溶液蒸干
移去酒精灯,用余热将溶液蒸干
.(3)根据相关知识,完成相关猜想和验证,将下表中空白部分补充完整
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3等物质 | 取少量固体A于试管中,滴加稀盐酸,并用蘸有澄清石灰水的小烧杯罩于试管口 | 澄清石灰水变浑浊 澄清石灰水变浑浊 |
猜想Ⅰ成立 |
| 猜想Ⅱ:最后制得的NaCl固体中仍含有少量Na2SO4 | 取少量NaCl晶体溶于试管中加入少量蒸馏水溶解, 加入盐酸, 加入盐酸, 然后向溶液中滴加BaCl2溶液 然后向溶液中滴加BaCl2溶液 |
产生白色沉淀 产生白色沉淀 |
猜想Ⅱ成立 |
分析:(1)粗盐提纯步骤为:溶解→过滤→蒸发结晶;
(2)蒸发实验中玻璃棒的作用是搅拌,防止液体局部过热;
(3)根据碳酸盐和盐酸反应的原理和硫酸根离子的检验方法;
(2)蒸发实验中玻璃棒的作用是搅拌,防止液体局部过热;
(3)根据碳酸盐和盐酸反应的原理和硫酸根离子的检验方法;
解答:解:(1)粗盐中含有泥沙,故应该先溶解然后再过滤而得到澄清溶液,最后蒸发结晶即可,所以步骤①和②的操作名称是过滤,故答案为:过滤;
(2)蒸发滤液时,必须用玻璃棒不断搅拌,目的是防止液体局部过热造成液滴飞溅;为防止固体烧焦,当蒸发皿中有较多量固体时,就应停止加热,
故答案为:溶液受热不均,造成液体飞溅; 移去酒精灯,用余热将溶液蒸干;
(3)盐酸的酸性比碳酸强,盐酸和碳酸钙和碳酸镁反应生成二氧化碳,二氧化碳是酸性氧化物,石灰水是氢氧化钙的水溶液.二氧化碳与氢氧化钙发生化学反应,生成碳酸钙和水,碳酸钙不溶于水,从而使澄清的水溶液变浑浊,所以当出现澄清石灰水变浑浊时可证明猜想Ⅰ成立;鉴定硫酸根离子的存在一般是加入钡盐生成硫酸钡的不溶于硝酸的白色沉淀完成鉴定,因为氯化银也是不溶于硝酸的白色沉淀,所以为防止氯离子的干扰一般先加入盐酸进行酸化,再进行硝酸的检验.硫酸钠和氯化钡反应生成氯化钠和硫酸钡沉淀,所以产生白色沉淀,可证明猜想Ⅱ成立,故答案为:
(2)蒸发滤液时,必须用玻璃棒不断搅拌,目的是防止液体局部过热造成液滴飞溅;为防止固体烧焦,当蒸发皿中有较多量固体时,就应停止加热,
故答案为:溶液受热不均,造成液体飞溅; 移去酒精灯,用余热将溶液蒸干;
(3)盐酸的酸性比碳酸强,盐酸和碳酸钙和碳酸镁反应生成二氧化碳,二氧化碳是酸性氧化物,石灰水是氢氧化钙的水溶液.二氧化碳与氢氧化钙发生化学反应,生成碳酸钙和水,碳酸钙不溶于水,从而使澄清的水溶液变浑浊,所以当出现澄清石灰水变浑浊时可证明猜想Ⅰ成立;鉴定硫酸根离子的存在一般是加入钡盐生成硫酸钡的不溶于硝酸的白色沉淀完成鉴定,因为氯化银也是不溶于硝酸的白色沉淀,所以为防止氯离子的干扰一般先加入盐酸进行酸化,再进行硝酸的检验.硫酸钠和氯化钡反应生成氯化钠和硫酸钡沉淀,所以产生白色沉淀,可证明猜想Ⅱ成立,故答案为:
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3等物质 | 取少量固体A于试管中,滴加稀盐酸,并用蘸有澄清石灰水的小烧杯罩于试管口 | 澄清石灰水变浑浊 | 猜想Ⅰ成立 |
| 猜想Ⅱ:最后制得的NaCl固体中仍含有少量Na2SO4 | 取少量NaCl晶体溶于试管中加入少量蒸馏水溶解,加入盐酸,然后向溶液中滴加BaCl2溶液 | 产生白色沉淀 | 猜想Ⅱ成立 |
点评:本题主要考查了粗盐提纯的实验,熟练该实验操作的注意事项和反应原理,熟练常用仪器的用途,是解答的关键.难度中等.

练习册系列答案
相关题目
从海水得到的粗盐含有少量的CaCl2、MgSO4等杂质,某同学用粗盐进行提纯,获取纯净的食盐,实验步骤如图所示.请回答:
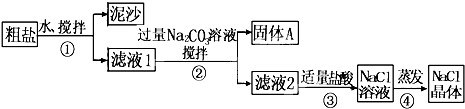
(1)步骤①和②的操作名称是______.
(2)步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止______,当蒸发皿中有较多量固体出现时,应______.
(3)根据相关知识,完成相关猜想和验证,将下表中空白部分补充完整
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3等物质 | 取少量固体A于试管中,滴加稀盐酸,并用蘸有澄清石灰水的小烧杯罩于试管口 | ______ | 猜想Ⅰ成立 |
| 猜想Ⅱ:最后制得的NaCl固体中仍含有少量Na2SO4 | 取少量NaCl晶体溶于试管中加入少量蒸馏水溶解,______ ______ | ______ | 猜想Ⅱ成立 |
从海水得到的粗盐含有少量的CaCl2、MgSO4等杂质,某同学用粗盐进行提纯,获取纯净的食盐,实验步骤如图所示.请回答:

(1)步骤①和②的操作名称是______.
(2)步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止______,当蒸发皿中有较多量固体出现时,应______.
(3)根据相关知识,完成相关猜想和验证,将下表中空白部分补充完整

(1)步骤①和②的操作名称是______.
(2)步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止______,当蒸发皿中有较多量固体出现时,应______.
(3)根据相关知识,完成相关猜想和验证,将下表中空白部分补充完整
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3等物质 | 取少量固体A于试管中,滴加稀盐酸,并用蘸有澄清石灰水的小烧杯罩于试管口 | ______ | 猜想Ⅰ成立 |
| 猜想Ⅱ:最后制得的NaCl固体中仍含有少量Na2SO4 | 取少量NaCl晶体溶于试管中加入少量蒸馏水溶解,______ ______ | ______ | 猜想Ⅱ成立 |