题目内容
18.一些烷烃的燃烧热(KJ/mol)如表:| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2-甲基丁烷 | 3531.3 |
| A. | 热稳定性:正丁烷<异丁烷 | |
| B. | 乙烷燃烧的热化学方程式为: 2C2H6(g)+7O2(g)→4CO2(g)+6H2O(g)△H=-1560.8KJ/mol | |
| C. | 正戊烷的燃烧热不超过3530 KJ/mol | |
| D. | 相同质量的烷烃,碳的质量分数越大,完全燃烧放出的热量越多 |
分析 A.燃烧热越高,物质的能量越高,能量越高越不稳定;
B.乙烷的燃烧热为1560.8KJ/mol,则2mol乙烷燃烧放出的热量为3121.6kJ;
C.正丁烷的燃烧热和其同分异构体的燃烧热相近,比含有支链的同分异构体高点,以此类比分析正戊烷的燃烧热;
D.根据物质的燃烧热,计算1g物质完全燃烧放出的热量进行判断.
解答 解:A.由表格中的数据可知,异丁烷的燃烧热比正丁烷的燃烧热小,则异丁烷的能量低,即热稳定性为正丁烷<异丁烷,故A正确;
B.正戊烷和2-甲基丁烷互为同分异构体,由表格中正丁烷、异丁烷的燃烧热比较可知,则互为同分异构体的化合物,支链多的燃烧热小,即正戊烷的燃烧热大于3531.3KJ/mol,故B错误;
C.乙烷的燃烧热为1560.8KJ/mol,则2mol乙烷燃烧放出的热量为3121.6kJ,所以热化学方程式为2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=-3121.6kJ/mol,故C错误;
D.1g甲烷、乙烷、丙烷、丁烷完全燃烧放出的热量分别为$\frac{891.0kJ}{16}$=55.69kJ,$\frac{1560.8kJ}{30}$=52.03kJ,$\frac{2221.5kJ}{42}$=52.89kJ,$\frac{2878.0kJ}{58}$=49.62kJ,不符合碳的质量分数越大,完全燃烧放出的热量越多,基本是氢元素质量分数越大,完全燃烧放出的热量越多,故D错误,
故选A.
点评 本题考查燃烧热、热化学方程式、反应热有关计算等,D选项为易错点,学生容易根据碳元素质量分数越大、燃烧热越大,得出放出的热量越大的错误结论.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
6.“类推”是一种常用的学习方法,但有时类推会产生错误的结论,下列类推结论中正确的是( )
| A. | NH4Cl加热分解只生成HCl和NH3,NH4I固体加热分解也只生成HI和NH3 | |
| B. | 第二周期元素氢化物的稳定性顺序是HF>H2O>NH3,则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 | |
| C. | 足量的CO2气体通入Na2SiO3中可生成NaHCO3; 足量的CO2气体通入石炭酸中也生成了NaHCO3 | |
| D. | 干冰(CO2)是分子晶体,则SiO2也是分子晶体 |
13.已知反应2A?B+3C,在20℃进行时其v(A)=5mol•L-1•s-1.如果温度每升高10℃,此反应速率增大到原来的2倍.则当其他条件不变时,温度升至50℃时,此反应的化学反应速率v(C)是( )
| A. | 20 mol•L-1•s-1 | B. | 40 mol•L-1•s-1 | C. | 60 mol•L-1•s-1 | D. | 150mol•L-1•s-1 |
3.“绿色化学”是当今社会提出的一个新概念.下列最符合绿色化学和原子经济要求的是( )
| A. | 将实验室的废酸液和废碱液先进行理后再排放 | |
| B. | 乙烷与氯气制备一氯乙烷 | |
| C. | 以铜和浓硝酸为原料生产硝酸铜 | |
| D. | 加成反应、酯化反应和加聚反应最符合“原子经济性” |
7.下列关于盐的水解的叙述中,正确的是( )
| A. | 盐类的水解过程是中和反应的逆过程,是吸热过程 | |
| B. | 易水解的盐溶于水后,都抑制了水的电离 | |
| C. | 易水解的盐溶液中,水电离出的以游离态存在的H+和OH-的浓度永远相等 | |
| D. | 易水解的盐溶液肯定不是中性的 |
8.十七大把“节能减排”工作放在更加突出的战略位置.下列有关的叙述中,错误的是( )
| A. | 实验室中“通风厨”能排出有害的气体,能防止有害气体污染大气环境 | |
| B. | 减少碳氢化合物、氮氧化物的排放可以有效的防止光化学烟雾的产生 | |
| C. | 处理废弃塑料制品较为合理的方法是用化学方法将废弃塑料加工成防水涂料或汽油 | |
| D. | 对废弃电池进行集中回收后处理的主要目的是防止重金离子的污染 |
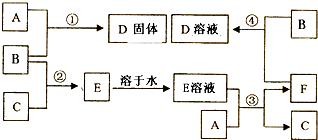
 、⑤ClCH=CHCl⑥
、⑤ClCH=CHCl⑥ 、⑦
、⑦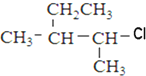 、⑧
、⑧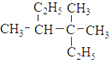 、⑨
、⑨

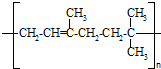 (或
(或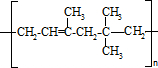 )
)
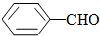
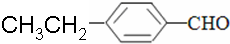 溶解性由大到小的顺序
溶解性由大到小的顺序