题目内容
常温下,下列关系的表述中,正确的是 ( )
| A.中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为l:l |
| B.pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)相等 |
| C.0.1 mol·L—NaHC03溶液中:c(Na+)>c(HCO3-)>c(CO32一)>c(H2C03) |
| D.浓度均为0.1 mol/L的三种溶液:①CH3COOH溶液;②NaOH溶液;⑧CH3COONa溶液,溶液的PH②>③>① |
D
试题分析:A、因为醋酸为弱酸,pH相等的醋酸浓度远远大于盐酸浓度,所以中和pH和体积都相同的盐酸和醋酸,醋酸消耗NaOH的物质的量大,错误;B、盐酸抑制水的电离,FeCl3抑制水的电离,错误;C、HCO3?的水解程度大于电离程度,所以c(Na+)>c(HCO3-)> c(H2C03) > c(CO32一),错误;D、NaOH为强碱,CH3COOH为弱酸,所以溶液的PH ②>③>①,正确。

练习册系列答案
相关题目
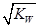 B. 混合液中:c(HA)+c(A-)=a mol·L-1
B. 混合液中:c(HA)+c(A-)=a mol·L-1