题目内容
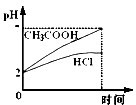
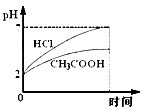
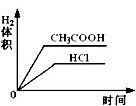
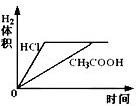
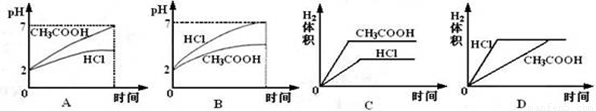
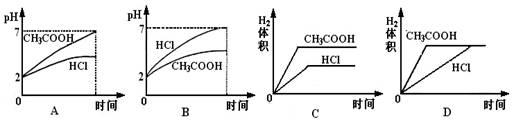
在体积均为1L,pH均等于2的盐酸和醋酸中,分别投入0.12g镁粉充分反应后,如图所示比较符合反应事实的曲线是( )
分析:n(HCl)=1L×0.01mol/L=0.01mol,n(Mg)=
=0.005mol,则HCl与镁恰好反应,由于醋酸为弱酸,不能完全电离,则醋酸浓度大于盐酸,与镁反应时,醋酸过量.
| 0.12g |
| 24g/mol |
解答:解:n(HCl)=1L×0.01mol/L=0.01mol,n(Mg)=
=0.005mol,
A、B.盐酸和镁恰好反应,醋酸为弱酸,反应后醋酸过量,溶液成酸性,则反应后醋酸pH较小,故A错误、B正确;
C.盐酸和镁恰好反应,醋酸过量,则镁完全反应,生产氢气体积相同,故C错误;
D.由于醋酸为弱酸,等pH时,醋酸浓度大,则醋酸反应较快,故D错误.
故选B.
| 0.12g |
| 24g/mol |
A、B.盐酸和镁恰好反应,醋酸为弱酸,反应后醋酸过量,溶液成酸性,则反应后醋酸pH较小,故A错误、B正确;
C.盐酸和镁恰好反应,醋酸过量,则镁完全反应,生产氢气体积相同,故C错误;
D.由于醋酸为弱酸,等pH时,醋酸浓度大,则醋酸反应较快,故D错误.
故选B.
点评:本题考查弱电解质的电离,题目难度不大,注意把握等pH时,醋酸浓度较大的特点.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目