题目内容
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如下图所示(不考虑C2O42-的水解)。下列叙述正确的是
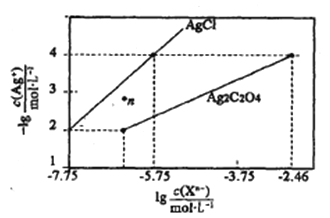
A. Ksp(Ag2C2O4)的数量级等于10-7
B. n点表示AgCl的不饱和溶液
C. 向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D. Ag2C2O4+2C1-=2AgCl+C2O42-的平衡常数为109.04
【答案】D
【解析】从图像看出,当c(C2O42-)=10-2.46 mol/L, c(Ag+)=10-4mol/L,Ksp (Ag2C2O4)= 10-2.46×(10-4)2=10-10.46,A错误;根据图像可知c(Ag+)=10-4mol/L,c(Cl-)=10-5.75 mol/L,所以Ksp(AgCl)= 10-4×10-5.75=10-9.75,n点中,c(Cl-)<10-5.75 mol/L,c(Ag+)>10-4 mol/L,浓度积c(Cl-)×c(Ag+)> Kp(AgCl),n点表示AgCl的饱和溶液,B错误; AgCl中c(Ag+)= Kp(AgCl)/c(Cl-)=10-9.75/ c(Cl-),Ag2C2O4中c(Ag+)= √Ksp(Ag2C2O4)/ c(C2O42-)=√10-10.46/ c(C2O42-)=10-5.23/ √c(C2O42-),假设c(Cl-)=c(C2O42-)=1 mol/L,则Ag2C2O4溶液中c(Ag+)较大,因此向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成沉淀AgCl,C错误;Ag2C2O4+2C1-=2AgCl+C2O42-的平衡常数为c(C2O42-)/ c2(Cl-)= c(C2O42-)×c2(Ag+)/ c2(Ag+)×c2(Cl-)=10-10.46/(10-9.75)2=109.04,D正确;正确选项D。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。己知:
Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
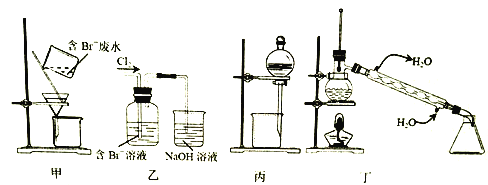
下列说法正确的是
A. 用甲装置过滤时,需不断搅拌
B. 丙装置中用正十二烷而不用CCl4,是因为其密度小
C. 用乙装置将Br-氧化为Br2
D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2
【题目】下表列出了某短周期元素R的各级电离能数据(单位为kJ·mol-1)。下列关于元素R的判断中一定正确的是( )
I1 | I2 | I3 | I4 | …… | |
R | 577.5 | 1816.7 | 2744.8 | 11577 |
①R的主要化合价中最高正价为+3价 ②R元素位于元素周期表中第ⅡA族
③R元素第一电离能小于同周期相邻元素 ④R元素基态原子的电子排布式为1s22s22p1
A. ①② B. ②③ C. ③④ D. ①③