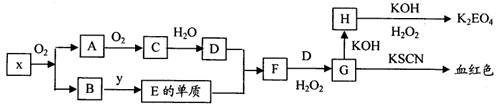
题目内容
向一定物质的量的Fe3O4和Fe的混合物中加50mL 2mol·L-1H2SO4,恰好使之完全溶解,并放出448mL(标况)气体。在所得溶液中加入KSCN溶液,不变红色,则用足量的CO在高温下与相同质量的此混合物反应,能得到多少克铁?
5.6g
按常规思路,应先求出Fe3O4和Fe的物质的量。
设此混合物中Fe3O4和Fe的物质的量分别为x和y,有
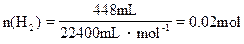
Fe + H2SO4====FeSO4+H2↑
0.02mol 0.02mol 0.02mol
Fe3O4+4H2SO4====FeSO4+Fe2(SO4)3+4H2O
x 4x x
所得溶液加入KSCN溶液不变红色,表明必然发生如下反应
Fe+Fe2(SO4)3====3FeSO4
x x
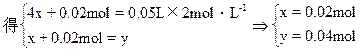
Fe3O4+4CO 3Fe+4CO2
3Fe+4CO2
0.02mol 0.06mol
故能得到铁的质量为(0.04+0.06)mol×56g·mol-1=5.6g
解答本题还可用电荷守恒原则和质量守恒定律,使运算过程化简。据Fe3O4和Fe溶于H2SO4后全部转化为FeSO4,则n(Fe2+)=n(SO42-)=n(Fe)=2mol·L-1×0.05L="0.1mol" m(Fe)=0.1mol×56g·mol-1=5.6g。
设此混合物中Fe3O4和Fe的物质的量分别为x和y,有
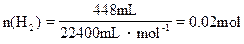
Fe + H2SO4====FeSO4+H2↑
0.02mol 0.02mol 0.02mol
Fe3O4+4H2SO4====FeSO4+Fe2(SO4)3+4H2O
x 4x x
所得溶液加入KSCN溶液不变红色,表明必然发生如下反应
Fe+Fe2(SO4)3====3FeSO4
x x
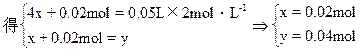
Fe3O4+4CO
 3Fe+4CO2
3Fe+4CO20.02mol 0.06mol
故能得到铁的质量为(0.04+0.06)mol×56g·mol-1=5.6g
解答本题还可用电荷守恒原则和质量守恒定律,使运算过程化简。据Fe3O4和Fe溶于H2SO4后全部转化为FeSO4,则n(Fe2+)=n(SO42-)=n(Fe)=2mol·L-1×0.05L="0.1mol" m(Fe)=0.1mol×56g·mol-1=5.6g。

练习册系列答案
相关题目