题目内容
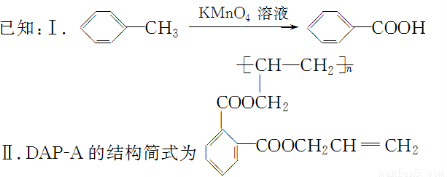
聚邻苯二甲酸二烯丙酯(DAP-A)是一种优良的热固性树脂,这种材料可以采取下列路线合成:
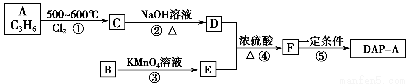
(1)反应①~④中,属于取代反应的是________。
(2)写出有关反应的化学方程式:
反应②___________________________________________________________;
反应④___________________________________________________________。
(3)G是E的同分异构体,G具有如下性质:①能发生银镜反应,且1 mol G与银氨溶液反应时最多可得到4 mol Ag;②遇FeCl3溶液呈紫色;③在稀硫酸中能发生水解反应。
则符合上述条件的G最多有________种,这些不同结构的物质,它们的核磁共振氢谱峰的数目有何特点?_______________________________________________________。
(4)工业上可由C经过两步反应制得甘油,试仿照题目中合成流程图的形式,写出这一合成过程:____________________________________________________________________。
(1)①②④
(2)


(3)10 各物质的核磁共振氢谱峰的数目相同,均为6种
(4)
【解析】由DAP-A的结构简式可推出 F的结构简式为

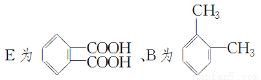 ,由此可知①②④是取代反应。由G的性质①知G分子中含有2个醛基,由性质②知G分子中含有苯环且苯环上有—OH,由性质③知G分子中含有酯基,综合前面的分析及E的分子式知G分子中含有1个HCOO—、1个—CHO、1个—OH,这3个取代基连在苯环上相邻3个碳原子上有3种不同结构,3个取代基互为间位关系的结构有一种,2个取代基相邻、1个取代基与它们相间有6种,故共有10种同分异构体。由于这10种同分异构体的结构中不存在对称关系,故这10种同分异构体的核磁共振氢谱峰的数目相同,均有6种。甘油分子中有三个羟基,故C应先与Cl2发生加成反应生成CH2ClCHClCH2Cl,然后再水解就可以得到甘油。
,由此可知①②④是取代反应。由G的性质①知G分子中含有2个醛基,由性质②知G分子中含有苯环且苯环上有—OH,由性质③知G分子中含有酯基,综合前面的分析及E的分子式知G分子中含有1个HCOO—、1个—CHO、1个—OH,这3个取代基连在苯环上相邻3个碳原子上有3种不同结构,3个取代基互为间位关系的结构有一种,2个取代基相邻、1个取代基与它们相间有6种,故共有10种同分异构体。由于这10种同分异构体的结构中不存在对称关系,故这10种同分异构体的核磁共振氢谱峰的数目相同,均有6种。甘油分子中有三个羟基,故C应先与Cl2发生加成反应生成CH2ClCHClCH2Cl,然后再水解就可以得到甘油。

某化学小组在学习元素周期律知识后,对教材中Cl2将Fe2+氧化成Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化成Fe3+,那么Br2和I2能否将Fe2+氧化成Fe3+?
环节一:理论推测。
部分同学认为Br2和I2都能将Fe2+氧化成Fe3+,依据是____________________
_________________________________________________________________。
部分同学认为Br2和I2都不能将Fe2+氧化成Fe3+。还有同学认为Br2能将
Fe2+氧化成Fe3+,而I2不能,依据是同一主族从上到下卤素单质的氧化性逐渐减弱。
环节二:设计实验进行验证。
向大试管中加入适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
试管 | 操作 | 现象 |
① | 先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量红棕色的溴水,振荡试管 | 溶液为 黄色 |
② | 先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量棕黄色的碘水,振荡试管 | 溶液为 黄色 |
环节三:实验现象的分析与解释。
(1)甲同学认为试管①中的现象说明溴水能将Fe2+氧化,反应的离子方程式为_________________________________________________________________。
乙同学认为应该补做实验,才能得出甲同学的结论。请你帮助乙同学完成实验:
实验2:
操作 | 现象 |
|
|
(2)该小组同学对试管②中所得的溶液呈黄色的原因展开讨论,并提出了两种假设:
假设1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
假设2.________________。
实验3:进行实验以判断假设是否成立。
操作 | 现象 |
向试管②所得的溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间。取出上层溶液,滴加KSCN溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;取上层溶液滴加KSCN溶液后,溶液呈浅红色 |
丙同学认为实验3的现象可以说明假设2成立,丁同学认为不严谨,于是设计了实验4继续探究。
实验4:
操作 | 现象 |
向另一支试管中加入2 mL新制的FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间。取出下层溶液,滴加KSCN溶液 | 静置后,上层溶液为紫色,下层溶液几乎无色;取下层溶液,向其中滴加KSCN溶液后,溶液没有呈浅红色 |
你认为实验4中加入乙酸乙酯的主要目的是___________________________。
丁同学根据实验4的现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,从原子结构角度解释原因:______________________________________________________________________。