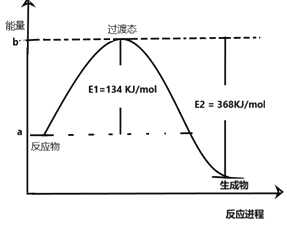
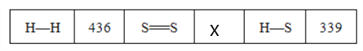
题目内容
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。(已知Co2O3的氧化性>Cl2的氧化性)。从废料中回收氧化钴(CoO)的工艺流程如下:
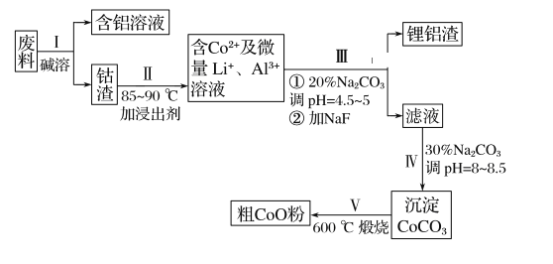
(1)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为__________。
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出含钴物质的反应化学方程式为(产物中只有一种酸根)__________________________________。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请分析不用盐酸浸出钴的主要原因:___________________________________________________________。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式:__________________________________。
(4)碳酸钠溶液在过程Ⅲ和Ⅳ中所起作用有所不同,请写出在过程Ⅳ中起的作用是_____。
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是________(填标号)。
A.c(Na+)=2c(CO![]() ) B.c(Na+)>c(CO
) B.c(Na+)>c(CO![]() )>c(HCO
)>c(HCO![]() )
)
C.c(OH-)>c(HCO![]() )>c(H+) D.c(OH-)-c(H+)=c(HCO
)>c(H+) D.c(OH-)-c(H+)=c(HCO![]() )+2c(H2CO3)
)+2c(H2CO3)
【答案】2Al+2OH-+2H2O===2AlO2-+3H2↑4Co2O3·CoO+Na2S2O3+11H2SO4===12CoSO4+Na2SO4+11H2OCo2O3·CoO可氧化盐酸产生Cl2,污染环境2Al3++3CO32-+3H2O===2Al(OH)3↓+3CO2↑调节pH,提供CO32-,使Co2+沉淀为CoCO3BCD
【解析】
废料用碱液溶解,过滤得到偏铝酸钠溶液和钴渣;用硫酸溶解钴渣,发生反应:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O,得到含有钴离子的溶液,然后调节溶液pH并用碳酸钠溶液除去杂质铝离子,得到较纯净的含有钴离子的溶液,再加入碳酸钠、调节溶液的pH将钴离子转化成碳酸钴沉淀,最后灼烧碳酸钴得到氧化钴。
(1)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子反应方程式为:2Al+2OH-+2H2O=+2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=+2AlO2-+3H2↑;
(2)Co3O4和Na2S2O3在酸性条件下发生氧化还原反应生成CoSO4、Na2SO4和H2O,反应方程式为:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O;盐酸具有还原性,能被Co2O3CoO氧化生成有毒的氯气而污染环境,所以不能盐酸,故答案为:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O;Co2O3CoO可氧化盐酸产生Cl2,污染环境;
(3)铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;故答案为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;
(4)碳酸钠溶液在过程Ⅲ中铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳;碳酸钠溶液在过程Ⅳ中调整pH,提供CO32-,使Co2+沉淀为CoCO3;故答案为:调整pH,提供CO32-,使Co2+沉淀为CoCO3;
(5)A.由物料守恒可知c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3),故A错误;B.碳酸根离子发生水解,且以第一步水解为主,所以溶液中离子浓度:c(Na+)>c(CO32-)>c(HCO3-),故B正确;C.碳酸根离子发生水解,水解呈碱性,且存在两步水解,则溶液中离子浓度:c(OH-)>c(HCO3-)>c(H+),故C正确;D.Na2CO3溶液中质子守恒:c(OH-)-c(H+)═c(HCO3-)+2c(H2CO3),故D正确;故答案为:BCD。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案