题目内容
【题目】Ag+与 I-既能发生沉淀反应又能发生氧化还原反应。为探究其反应,进行下列实验:
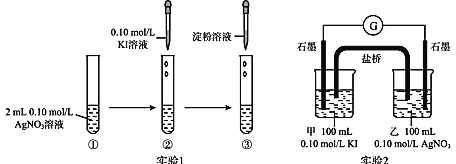
实验现象如下:实验 1 中试管②出现浅黄色沉淀,试管③无蓝色出现;实验 2 中电流计指针发生明显偏转。下列有关说法中错误的是
A.实验 1 中 Ag+与 I-沉淀反应速率更大
B.向实验 2 甲烧杯中滴入淀粉,溶液变蓝
C.实验 2 装置的正极反应式为 Ag++e- = Ag
D.实验 2 中 Ag+与 I-沉淀反应速率大于 0
【答案】D
【解析】
由题意可知Ag+与I-可发生沉淀反应Ag++ I-=AgI↓、氧化还原反应2Ag++2I-=2Ag+I2,二者相互竞争。
A.实验1中试管②出现浅黄色沉淀,试管③无蓝色出现,表明无I2生成或生成的I2没检出,说明Ag+与I-发生沉淀反应占优势,故A正确;
B.实验2中电流计指针发生明显偏转,则实验2的装置一定为原电池(无外加电源),表明Ag+与I-发生氧化还原反应2Ag+ +2I-=2Ag+ I2,淀粉遇碘变蓝,故B正确;
C.根据Ag+与I-发生氧化还原反应2Ag+ +2I-=2Ag+ I2,该原电池负极反应为2 I--2e-=I2,正极反应为Ag++e-=Ag,故C正确;
D.实验2中AgNO3、KI溶液分别在甲乙烧杯中,并未相互接触,故二者间不会发生沉淀即速率为0,故D错误;
答案选D。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】在体积恒定为3L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)上述反应涉及三种元素,其中原子半径最大的元素核外电子排布式为_________,原子核外电子运动状态最多的元素是_______(写元素符号)。
(2)上述反应所涉及的四种物质中非极性分子的沸点顺序是_____,其主要原因是_________。
(3)该反应的化学平衡常数表达式为_______;该反应的正方向是________反应(选填“吸热”、放热)
(4)某温度下,2min内生成10.8g H2O(g),用CO浓度变化表示这段时间内的平均反应速率为____________;若平衡时各物质浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O),试判断此时的温度为_________℃
(5)能判断该反应是否达到化学平衡状态的依据是_______
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)