题目内容
某无色溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42- 等离子中的几种,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。下列说法一定正确的是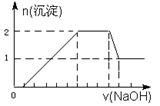
| A.一定存在H+、Mg2+、Al3+、NH+4,一定不存在Na+、SO2-4、Fe3+ |
| B.一定存在H+、Al3+、NH+4、SO2-4,可能存在Na+、Mg2+ |
| C.溶液中c(H+)∶c(Al3+):c(Mg2+)为1∶1∶1 |
| D.溶液中c(H+)∶c(SO2-4)为2∶9 |
C
解析试题分析:无色溶液肯定没有三价铁离子。从图象可知,开始时无沉淀产生,说明含有H+,H++OH-=H2O,该氢离子消耗NaOH溶液的体积为1体积,图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3 H2O,铵根消耗氢氧化钠为3体积,最后溶液中有沉淀,说明溶液中含Mg2+,肯定含有Al3+,根据Al3++3 OH-=Al(OH)3↓,铝离子消耗NaOH溶液的体积为3体积,氢氧化铝沉淀溶解消耗1体积氢氧化钠,沉淀的量减小1mol,可知铝离子为1mol。生成2mol沉淀时共消耗5mol的氢氧化钠,其中铝离子占了3mol,还有2mol是镁,镁离子的物质的量为1mol。所以可得到H+、Al3+、Mg2+的物质的量之比为1:1:1。钠离子不能确定有无。选C。
点评:本题考查离子的判断和计算,题目难度中等,要求学生熟记物质的性质并灵活应用。

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
下列离子方程式与所述事实相符且正确的是
| A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- |
| B.用FeCl3溶液腐蚀铜板制印刷电路板:Fe3++2Cu=Fe2++2Cu2+ |
| C.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓ |
| D.碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O |
下列离子方程式正确的是( )
| A.澄清的石灰水与稀盐酸反应 Ca(OH)2 + 2H+= Ca2+ + 2H2O |
| B.稀硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-= H2O +BaSO4↓ |
| C.铜片插入硝酸银溶液中 Cu + Ag+= Cu2+ + Ag |
| D.氧化铁与稀盐酸混合:Fe2O3+6H+=2Fe3++3H2O |
在无色的强酸性溶液中能大量共存的是
| A.Mg2+、Na+、Cl-、SO42- | B.K+、 Na+、 Cl-、 Cu2+ |
| C.K+ 、Na+、NO3-、CO32- | D.Na+、Ba2+、OH-、SO42- |
在透明溶液中,下列各组离子能大量共存的是
| A.HCO3-、ClO-、K+、H+ | B.Na+、Fe2+、NO3-、H+ |
| C.K+、Cu2+、Cl-、SO42- | D.OH-、NH4+、Cl-、SO32- |
在水溶液中能大量共存的一组离子是 ( )。
| A.Na+、Ba2+、Cl-、NO3— | B.Pb2+、Hg2+、S2-、SO42— |
| C.NH4+、H+、S2O32—、PO43— | D.Ca2+、Al3+、Br-、CO32— |
下面4组物质,能起反应,且既属于离子反应,又属于氧化还原反应的是( )
| A.Na2SO4溶液和BaCl2溶液 |
| B.铝片与Hg(NO3)2溶液 |
| C.稀硫酸与铜片 |
| D.NaNO3溶液与KCl溶液 |
解释下列现象的化学用语正确的是( )
A.铁钉在空气中出现红色的铁锈,其负极反应式为:Fe-3e- Fe3+ Fe3+ |
B.氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+2N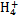  Mg2++2NH3·H2O Mg2++2NH3·H2O |
C.SO2通入到滴加酚酞的NaOH溶液中,红色变浅:SO2+2OH- S S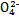 +H2O +H2O |
D.向K2Cr2O7溶液中加入少量NaOH浓溶液,溶液由橙色变为黄色:Cr2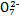 +H2O +H2O 2Cr 2Cr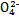 +2H+ +2H+ |
