题目内容
下图是一种正在投入生产的大型蓄电系统。左右两侧为电解质储罐,中央为电池,利用2Na2S2+NaBr3 Na2S4+3NaBr反应原理进行工作,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过。
Na2S4+3NaBr反应原理进行工作,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过。
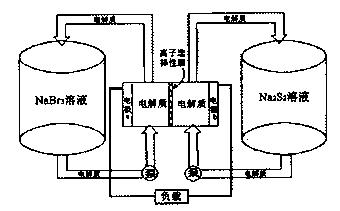
(1)当蓄电池工作放电时,电池中Na+的移动方向是:____ (填“电极a→b”或“电极b→a”),电极a的电极名称为 ,发生的电极反应为 。
(2)当蓄电池处于充电状态时,电极a应接外电源 极(填“正”或“负”),电极b的电极名称为 ,发生的电极反应为 。
(3)若左侧储罐的中溶液体积为VL(导管、泵及电池内部溶液忽略不计),一段时间观察,溶液中Na+的平均浓度由c1mol·L-1降至c2mol·L-1,则此装置该段时间正处于 (填“放电”或“充电”)状态,此过程中电极b上转移电子的物质的量共有__ mol。
 Na2S4+3NaBr反应原理进行工作,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过。
Na2S4+3NaBr反应原理进行工作,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过。
(1)当蓄电池工作放电时,电池中Na+的移动方向是:____ (填“电极a→b”或“电极b→a”),电极a的电极名称为 ,发生的电极反应为 。
(2)当蓄电池处于充电状态时,电极a应接外电源 极(填“正”或“负”),电极b的电极名称为 ,发生的电极反应为 。
(3)若左侧储罐的中溶液体积为VL(导管、泵及电池内部溶液忽略不计),一段时间观察,溶液中Na+的平均浓度由c1mol·L-1降至c2mol·L-1,则此装置该段时间正处于 (填“放电”或“充电”)状态,此过程中电极b上转移电子的物质的量共有__ mol。
(1)电极b→a (2分) 正极(1分) Br— 3+2e-=3Br-(2分)
(2)正(2分) 阴极(2分) S2— 4+2e-=2S2— 2(2分) (3)充电(2分) (c1—c2)V(2分)
(2)正(2分) 阴极(2分) S2— 4+2e-=2S2— 2(2分) (3)充电(2分) (c1—c2)V(2分)
试题分析:(1)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据总的反应方程式可知,Na2S2失去电子,被氧化,所以b电极是负极,因此当蓄电池工作放电时,电池中Na+的移动方向是电极b→a。电极a的电极名称为是正极,发生还原反应,因此电极反应式是Br— 3+2e-=3Br-。
(2)电极a是正极,因此当蓄电池处于充电状态时,电极a应接外电源正极。电极b与外接电源的负极相连,作阴极,得到电子,发生还原反应,因此此时电极反应式是S2— 4+2e-=2S2— 2。
(3)放电时钠离子向左侧移动,因此当左侧钠离子浓度降低时,说明处于充电状态。钠离子带1个正电荷,所以根据电荷守恒可知,此过程中电极b上转移电子的物质的量共有(c1—c2)mol/L×VL=(c1—c2)V。

练习册系列答案
相关题目
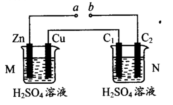
 a
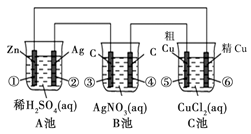
a 电极上发生还原反应
电极上发生还原反应

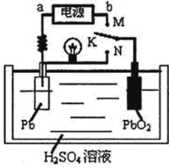
 2PbSO4+2H2O
2PbSO4+2H2O